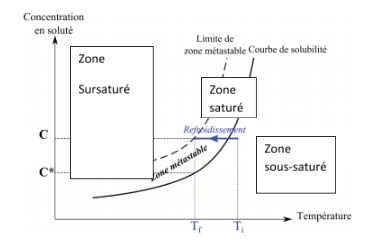
Bonjour, j'ai quelques petites questions concernant la cristallisation.
1)Les phénomènes de nucléations ont-ils lieu uniquement à partir de la limite métastable? si oui, que se passe-t-il dans la zone métastable ?
2) D'après mes lectures, je me rend de plus en plus compte que cristallisation et dissolution sont 2 processus qui s'oppose. Si tel est le cas, qu'est ce qui relie cristallisation, dissolution et solubilité ?
merci d'avance
-----