bonjour TLM
quelqu'un peut m'aider SVP j'ai vraiment coinsé dans cet exercice
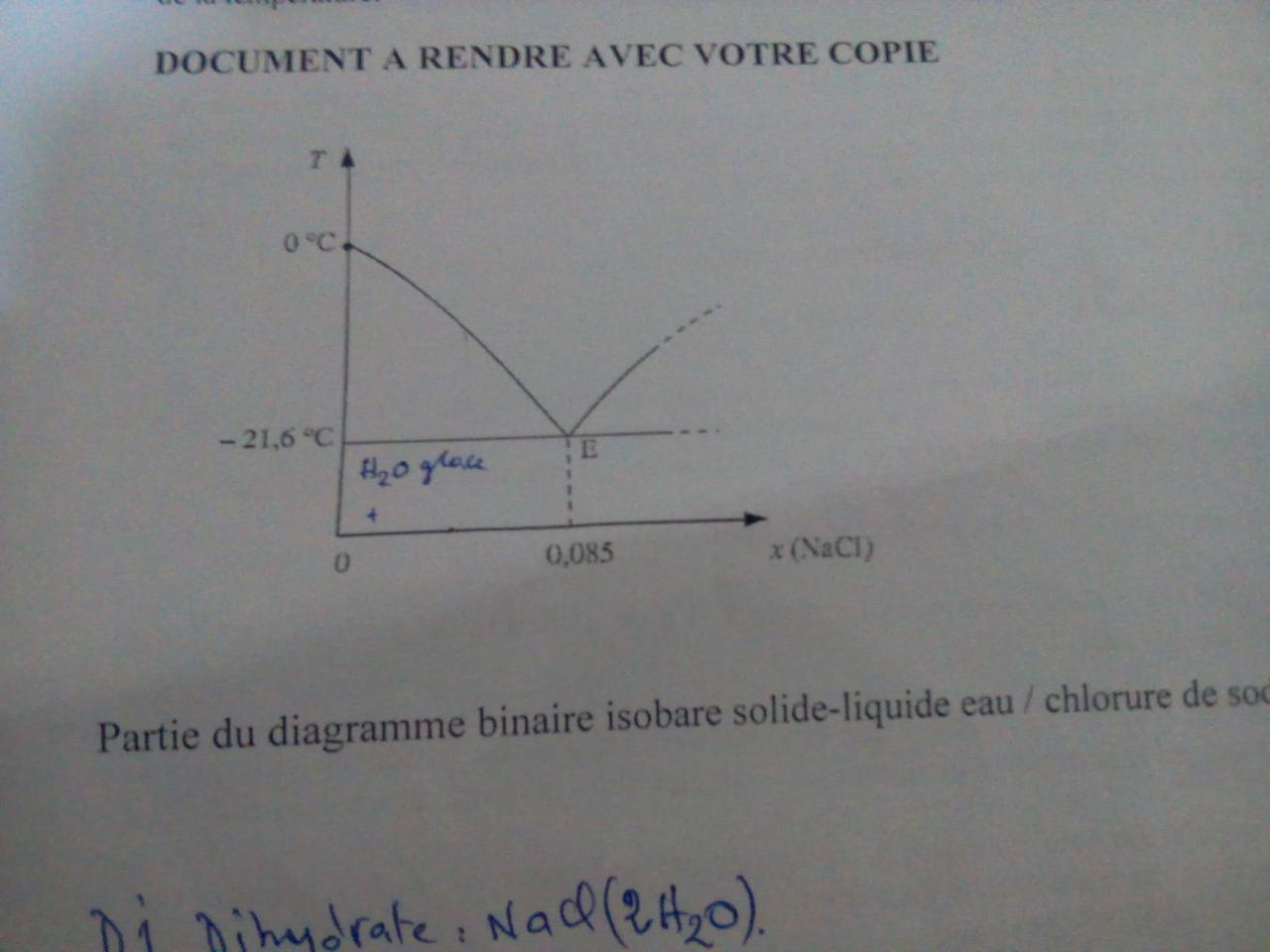
Le début du diagramme isobare (P = 1 bar) eau – chlorure de sodium, pour de petites teneurs en sel, a l’allure donnée sur la figure jointe. L’abscisse x(NaCl) représente la fraction molaire en chlorure de sodium NaCl.
1. Préciser la nature (état physique, nombre de phases et nature des corps en présence) dans les différents domaines de ce diagramme.
Est-ce que le chlorure de sodium est soluble dans l’eau ? et dans la glace ?
Comment appelle t’on le point E ? Du point de vue thermodynamique, qu’est ce qui le différencie d’un corps pur ?
Calculer la fraction massique w en NaCl (w = masse de NaCl pour 100 g de solution) correspondant à la fraction molaire de l’eutectique, sachant que sa densité est de 1,06.
2. Dans l’hypothèse où la solution liquide est idéale, donner l’expression du liquidus sous la forme ln (x) = f(T), où représente la fraction molaire de l’eau liquide. Dans cette expression, figurent également la température de fusion de l’eau pure T* et l’enthalpie de fusion de l’eau pure ΔH°fusion(H2O), ainsi que la constante des gaz parfaits R.
Application numérique : calculer la température de congélation d’une eau additionnée de NaCl, avec une fraction massique de 6,5 %. On considèrera que la densité de l’eau salée est égale à 1 dans ce domaine de concentration. Dans le calcul, on n’oubliera pas que, lorsqu’elle se dissout, une molécule de NaCl donne deux ions Na+ et Cl-.
3. Ajout de sel dans des conditions isothermes : application au salage des routes.
On ajoute à de la glace à -10°C du chlorure de sodium.
Faire figurer sur le diagramme de phases la fraction molaire minimale en sel pour que toute la glace fonde à cette température. Estimer la concentration massique en sel en g. L-1.
Quelle est la température limite en dessous de laquelle le salage des routes sera inefficace ?
4. Ajout de sel dans des conditions adiabatiques. Application aux mélanges réfrigérants.
Dans un vase Dewar (isolant thermique), on place 500 g de glace et 500 g d’eau à 0°C. On rajoute une masse de NaCl de 58,5 g.
4.1. On fait d’abord l’hypothèse que la glace ne fond pas. La fusion du chlorure de sodium dans l’eau est légèrement endothermique. Calculer alors la température d’équilibre du mélange .
Placer le point figuratif du mélange sur le diagramme isobare (point M). Montrer que cette solution est en désaccord avec le diagramme.
j'ai arrivé a resoudre la question N1 mais 2 et 4 non
-----