Bonjour,
Je suis étudiant en licence chimie de synthèse. J'ai un exercice de génie chimique sur les équilibres de phases à faire pour nous exercer. Mais, je rencontre des difficultés et je ne comprends pas tout. Si quelqu'un pourrait m'éclaircir, je l'en remercie d'avance !
Voici l'énoncé :
L'objectif est de séparer un mélange de A et de B par une distillation continue. C'est un mélange idéal. Il n'y a pas d'azéotrope. Le tout se fait à pression atmosphérique. La charge de la colonne contient 50% en masse de A. La quantité à distiller est de 15 tonnes. Le débit à distiller est de 1500 kg/h. Le condenseur est régulé. Ainsi, il y a une condensation totale des vapeurs. La colonne est dimensionnée de façon à ce que le titre massique du pied soit de 2% et en tête de 95%.
ATTENTION : tous les calculs seront faits en mole.
Voici les données fournies :
M(B) : 153.82 kg/ kmol
M(A) : 84.93 kg/ kmol
cp du soutirat = cp B =cp A : 0.6 kcal/kg°C
Kinox : 500 kcal/m2 °C
alpha :2.8
T°eb B : 76.9°C
T°eb A : 40°C
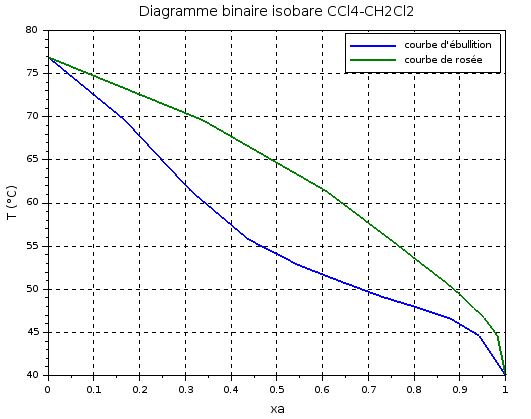
Voici le tableau des titres massiques du mélange binaire :
Xa 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9
Ya 0,220 0,460 0,620 0,715 0,785 0,8425 0,880 0,920 0,9675
T (en °C) 69,6 61,4 55,8 52,8 50.8 49,1 47.85 46,6 44,6
Voici le diagramme :
Questions :
a) Déterminer les débits molaires de l'alimentation, du distillat et du soutirat
Je sais qu'un débit molaire s'exprime en mol/h. Je suppose que les informations suivantes sont nécessaires pour répondra à la question :''La charge de la colonne contient 50% en masse de A. La quantité à distiller est de 15 tonnes. Le débit à distiller est de 1500 kg/h'' et ''La colonne est dimensionnée de façon à ce que le titre massique du pied soit de 2% et en tête de 95%.''
Du coup, pour le débit molaire de l'alimentation : On nous dis que : ''La charge de la colonne contient 50% en masse de A. Donc XA (fraction massique) = 0,5 ? Mais nous on veut xA (fraction molaire). On sait que : Pièce jointe 401483
Si on connait xA, on peut ainsi calculer n car on connait aussi MA, MB et m ( = 10 tonnes). Pièce jointe 401484
Mais il faut faire attention aux unités et mettre m en kg non ? C'est bien cela ?
Ensuite, on a n. Du coup on sait que le débit massique est de : 1500 kg/h et qu'on a 10t, on en déduit h (le temps). Et on divise n par h (pour avoir le débit molaire ?).
Mais je pense que mon raisonnement est faux et qu'il me manque des étapes...
Pour le débit molaire du distillat et du soutirat, je n'ai aucune idée... Peut-être faut-il faire un bilan matière ?
b) Donner les T° de pied , tête et alimentation
T° pied et en tête : Je pense que l'on détermine ça à partir du graphique ?
Je ne sais pas ce que l'on entend par T° de l'alimentation ?
c) Pour un facteur de charge de 1, avec f = u * racine ( masse volumique) avec u en m/s et masse volumique ( kg/m3) déterminer :
- u vitesse des gaz en tête de colonne
- masse volumique des gaz en tête de colonne
- diamètre de la colonne.
d) Même question mais pour une pression de fonctionnement de 25 mbar
Pour les questions c et d, je bloque complètement. Je n'ai aucune piste et je n'ai jamais traité cela en cours. Si vous pouvez me donner quelques pistes afin que je puisse avancer...
J'ai vraiment envie de comprendre cette exercice et je vous remercie par avance pour votre aide
Bonne soirée à vous !
-----