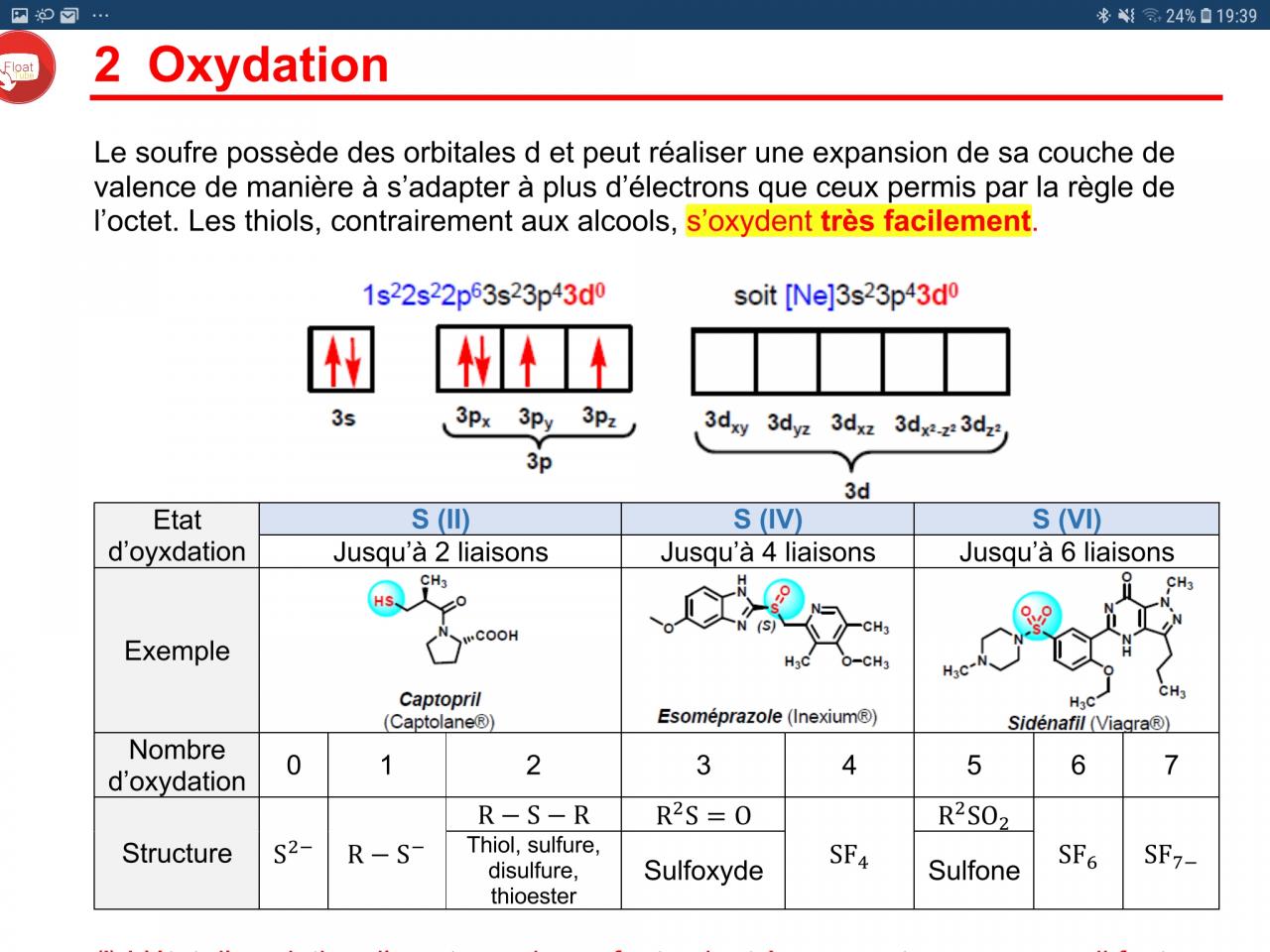
Bonjour,
Il y a un tableau dans mon cours que je n'arrive vraiment pas à comprendre, le voici :
La prof n'ayant pas expliqué comment trouver ces valeur de nombre et d'état d'oxydation, j'ai du commencer a me renseigner par moi meme. Le problème étant que pour commencer, quelle est la différence entre nombre et état d'oxydation ? Mes recherches sur internet me disent qu'il n'y a aucune difference entre ces deux expressions, et pourtant la prof fait la différence. Pourriez vous m'expliquer la différence que la prof fait entre les 2, et à quoi ils servent ?
Ensuite, après avoir cherché comment les retrouver, ben je ne retrouve pas les même valeur (que ce soit pour le nombre ou l'état).
Si j'ai bien compris comment calculer ce nombre, il faut s'aider des electronegativité des substituants de l'atome dont on cherche le nombre d'oxydation. Si ce dernier est relié à un atome + electronégatif (il va s'appauvrir en électron) on va faire +I au nombre, et si il est relié a un atome - electronegatif, on fait -I. A cela, on ajoute la charge de cet atome (enfin je crois... ? Je dis ça car pour le S2- du tableau, le nbre d'oxydation est égal à 0... alors qu'avec cette methode on a -2...).
N'hésitez surtout pas à me corriger si je fait une erreur.
En plus, le truc c'est que je ne sait pas comment placer l'electronegativité du soufre par rapport au carbone. Je sais que le soufre est très légèrement supérieur, mais c'est presque égal donc je ne sais pas si ça compte...
-----