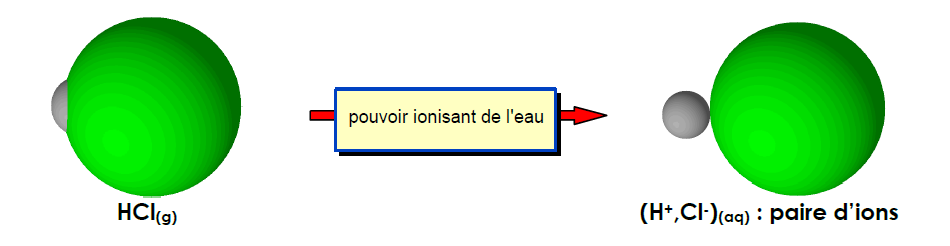
Bonjour,
J'ai du mal à comprendre deux notions : la dissociation et la dispersion lors d'une mise en solution aqueuse d'espèces ioniques : dans mon cours, il est dit que cette dissolution s'effectue en trois (ou quatre) étapes : (l'ionisation), la dissociation des ions, la solvatation des ions, puis la dispersion des ions, sous l'effet de l'agitation.
Or, dans un autre document, il était écrit que la dissociation et la dispersion était en fait le même phénomène, qui s'effectuait avant la solvatation. Dans ce même document, la dispersion des ions après solvatation n'était pas mentionnée.
J'aimerais donc savoir quel document décrit le mieux le phénomène.
Merci.
-----