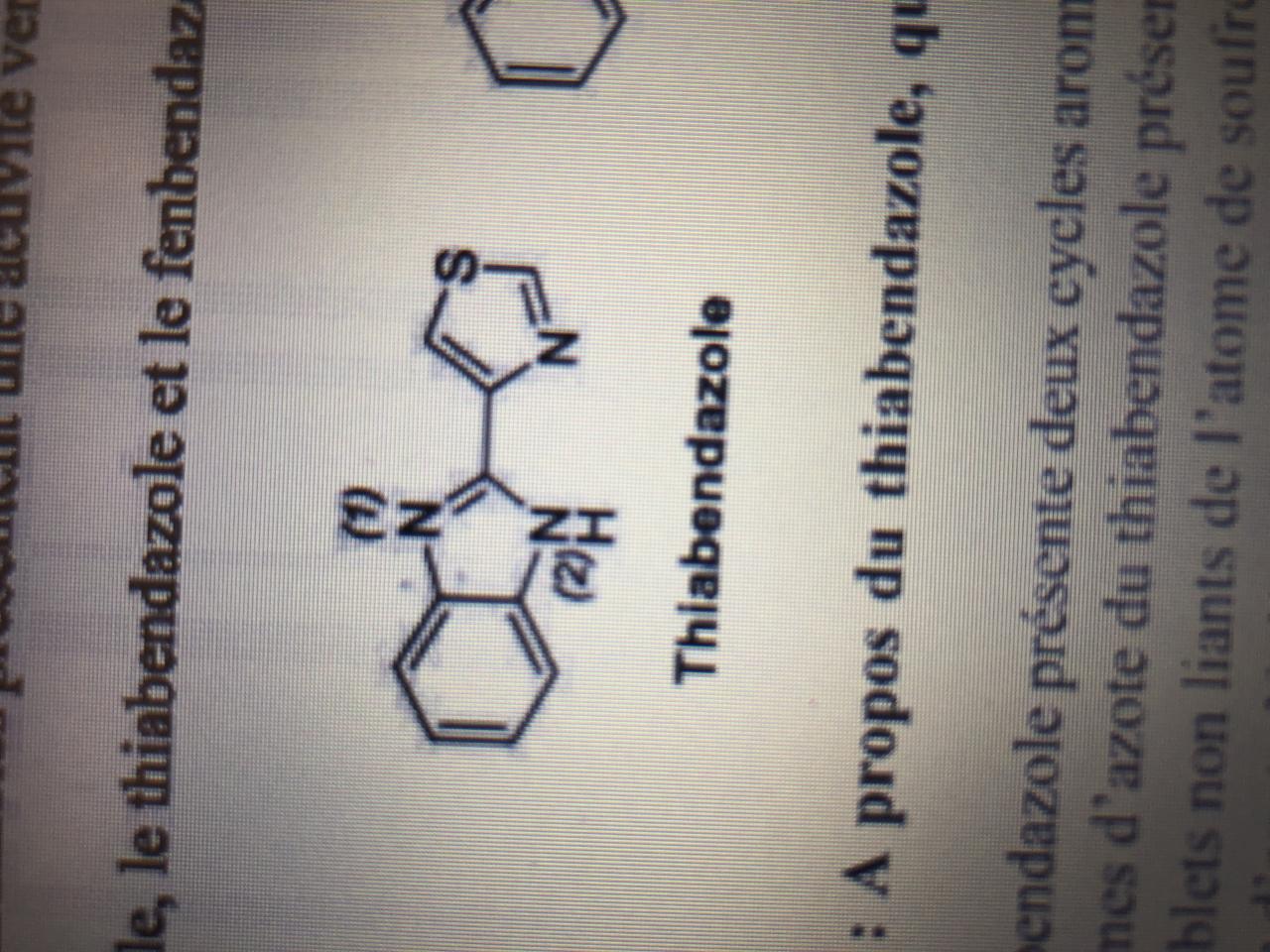
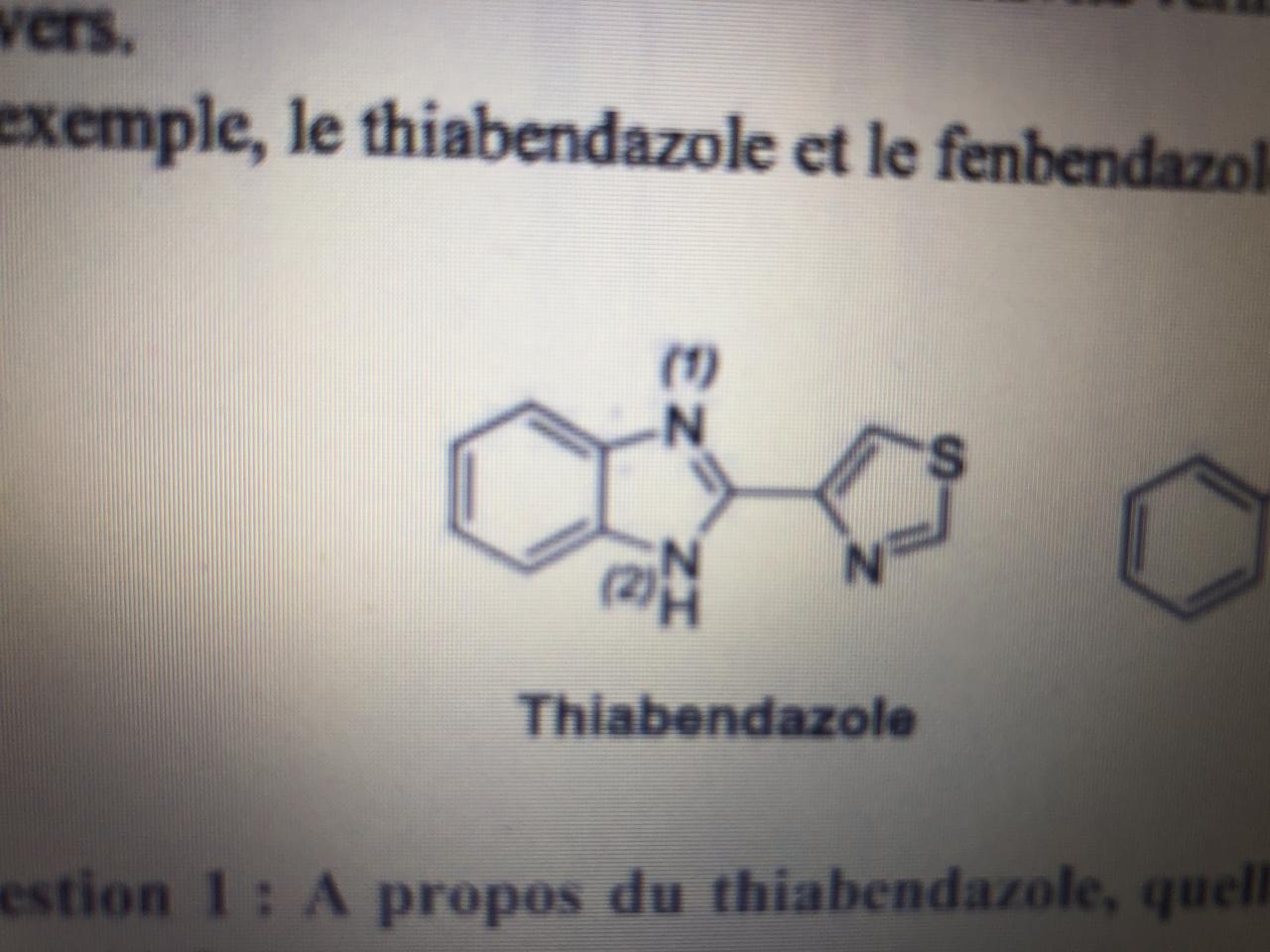
Bonjour à tous, je souhaite avoir votre avis sur mon raisonnement pour voir si j’ai bien compris la notion d’hybridation :
La correction stipule que l’un des doublets non liants de l’atome de Souffre se situe dans une orbitale p et l’autre doublet dans l’orbitale sp2.
Mon interrogation était pourquoi une hybridation sp2 et pourquoi le DNL se situe-il dans une orbitale p ?
De ce que j’ai compris : l’Atome de Souffre est de type AL2E2, donc normalement sp3, sauf qu’il y’a un effet mésomère donneur donc S posséde un doublet non liant délocalisable.
1-Je raisonne comme si le doublet était delocalisée et qu’il n’appartient plus à l’atome: S est de type AL2E1, donc bien une hybridation sp2.
2-Le doublet non liant delocalisable se situe dans l’orbitale p car il sera délocalisé donc «*il ne s’adapte pas*» à la structure de l’atome qui le porte.
Est ce bien ça ? Et peut-on raisonner comme si le doublet délocalisable est déjà délocalisé ?
Merci et bonne soirée à vous
-----