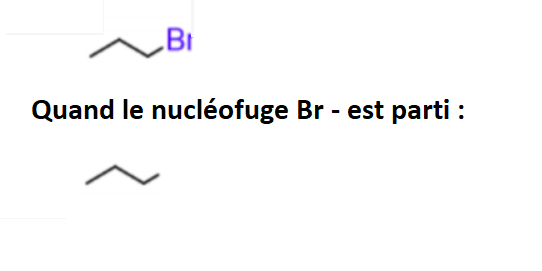
Bonjour,
J'ai un peu de mal à comprendre en quoi la réaction dans la pièce jointe est une SN2.
Je voudrais préciser que je connais les propriétés des différents mécanismes, seulement, j'ai un peu de mal à les appliquer.
Pourriez vous me donner un coup de main s'il vous plait ?
Merci beaucoup
Bonne soirée !
1 pièce jointe :
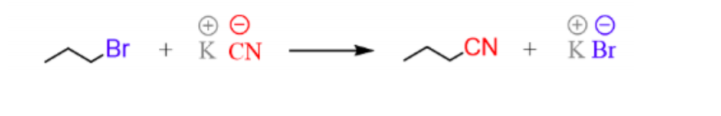
-----



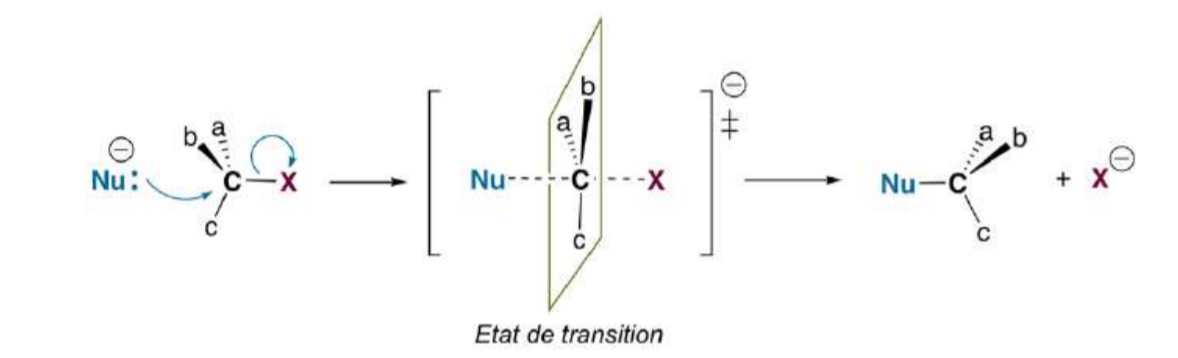

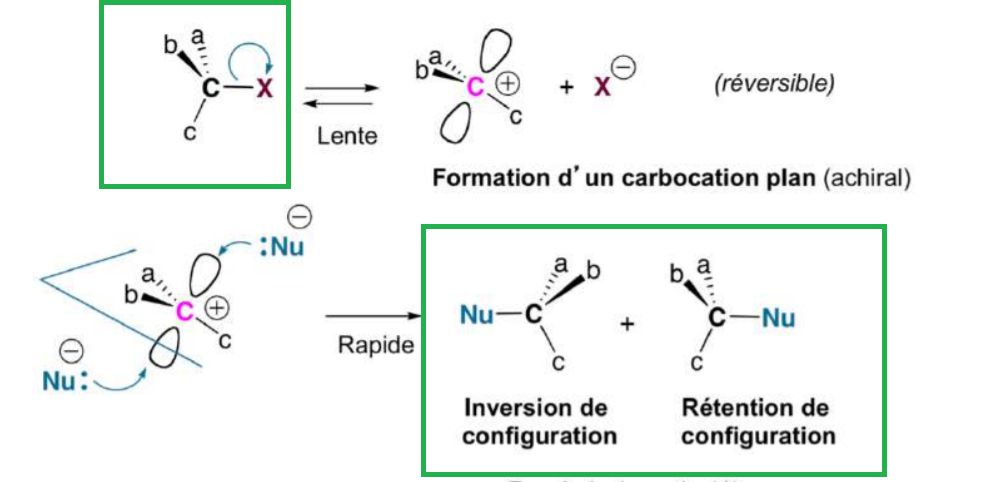
 j'ai beaucoup de chapitre, je viens de commencer celui ci...
j'ai beaucoup de chapitre, je viens de commencer celui ci...