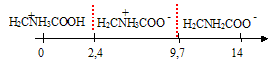Bonjour,
J'ai beaucoup de mal avec la chimie des solutions. Je dois préparer un TP et faire plusieurs dosages potentiométriques puis les interpréter. Je voudrais déterminer les volumes équivalents.
Seulement je ne comprend pas les réactions qui entrent en jeu et comment on pourrait calculer l'équivalence.
Dosage 1: -Dans le bécher, 10ml de glycine à 0.1mol/L + 1mL de HCl 1M + 14mL d'eau
-On titre par du HCl 1M
La glycine est un amphotère
Du coup, je me dit qu'avant équivalence elle devrait être dans sa forme acide HOOC-CH2-NH3+ (AH+) en équilibre avec sa forme -OOC-CH2-NH3+ (A)
et donc après équivalence il ne restera plus que la forme -OOC-CH2-NH3+ (AH+).
Mais je ne vois pas comment mettre ça dans l'équation de Nernts vu qu'on a aucun potentiel. Et ensuite comment utiliser ces équations de potentiels pour trouver Veq.
Pour moi c'est une réaction acido-basique et j'ai du mal à comprendre pourquoi utiliser un dosage potentiométrique.
Enfin, je comprend que les ions (H+ ; Cl-) vont avoir une influence sur le potentiel et que du coup au départ on est au potentiel de la solution dans le bécher puis après avoir totalement consommé la glycine les H+ sont en excès et donc le potentiel est plus proche de celui de HCl. Sauf qu'on a aucun couple ?
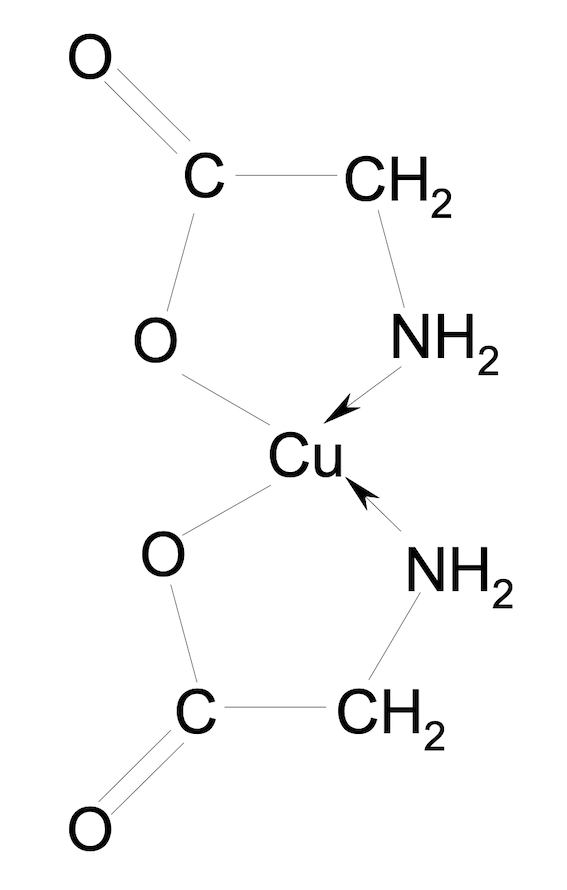
Dosage2: - Dans le bécher, 10mL de glycine + 1 ML de HCl 1M + 5mL de CuCl2;2 H2O + 9mL d'eau
-On titre par du HCl 1M
Le sel de cuivre se dissous dans l'eau en Cu2+ et 2 Cl-
Comme on a quand même du HCl dans le bécher on aurait avant l'équivalence un équilibre entre CuCl+ et CuCl2
Et après l'équivalence j'imagine qu'on aura tout précipité en CuCl2.
Et donc il faudrait aussi utiliser l'équation de Nernts pour trouver le volume équivalent.
Voilà, si vous pouvez m'expliquer comment résoudre mon problème. Que je puisse comprendre par où je dois commencer et si mes suppositions sont bonnes car là je me sens noyée!!
Merci beaucoup!!
-----