Bonjour, j'espère que vous allez bien. J'ai un devoir de chimie à faire dont je n'ai pas très bien compris l'énoncé. Le voici :
l'eau oxygénée, en milieu acide, suivant l'équation-bilan :
2I-+ H₂O₂ + 2H+→ I2 + 2 H₂O
On peut déterminer le temps nécessaire pour qu'il se forme n moles de diiode I2 en ajoutant à l'avance des quantités fixées de thiosulfate de sodium Na2S₂O3 qui réagit rapidement avec le diiode suivant l'équation-bilan :
2 S₂02- 3 + I2 > S40²6- +2I-
Dans ce but, on prépare une solution contenant: - 20 mL de solution d'iodure de potassium Kl de -
concentration 1 mol.L¹;
assez d'eau pour considérer le volume de la
solution finale comme constant;
une solution permettant de maintenir la con centration en ion H+ constante;
- 2 mL d'une solution de thiosulfate de sodium
de concentration 1 mol.L¹;
- quelques gouttes d'une solution d'empois
d'amidon.
A l'instant t = 0, on ajoute 1 mL d'une solution d'eau oxygénée de concentration 9,88 mol.L¹.
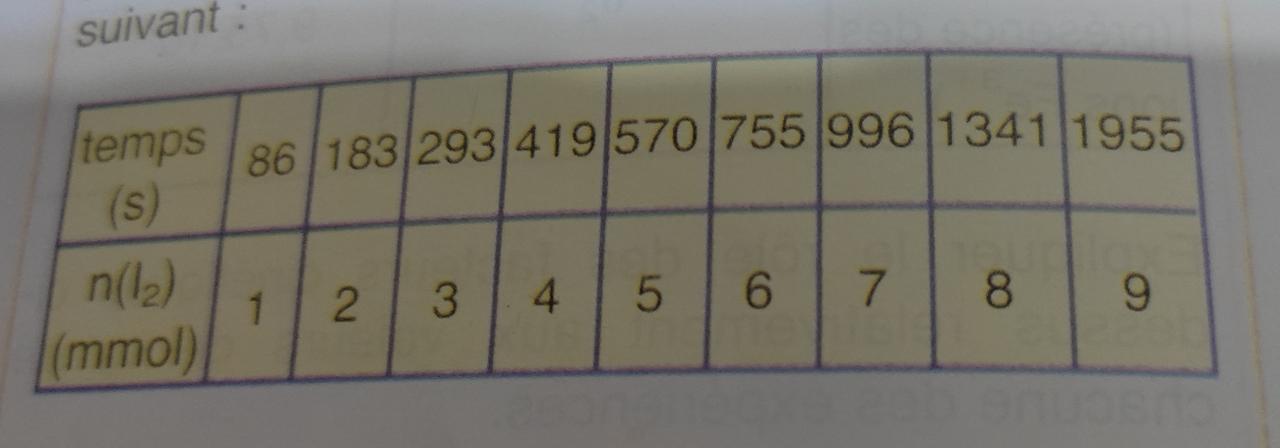
A l'instant t₁ = 86 s apparaît la coloration bleu foncé de l'indicateur. On ajoute alors 2 mL de la solution de thiosulfate qui fait disparaître la couleur. Celle-ci réapparaît à l'instant t₂ = 183 s. On ajoute de nouveau 2 mL de la solution de thiosulfate de sodium ... et ainsi de suite. Ce qui permet de dresser le tableau de résultats suivant :
(Voir photo)
a) Donner deux exemples de calcul de n(I₂), en effectuant ces calculs pour les nombres de moles n₁ et n₂ correspondant aux deux premières additions de la solution de thiosulfate de sodium.
(Il y'a éventuellement d'autres questions mais je pense être capable de les résoudre voici pourquoi je n'ai tapé que la partie a ! M'enfin, ce qui me pose problème c'est l'ajout de 2 ml de thiosulfate de sodium à certains instants ; comment ça se fait que l'on en rajoute 2ml ? Surtout, comment ça se fait que l'on en rajoute 2ml à chaque fois, le volume (le nombre de moles plutôt) dont aura besoin la quantité de I2 formée pour réagir avec n'est elle pas sensée diminuer au cours du temps ? J'ai essayé d'y réfléchir moi-même et je suis arrivée à la conclusion (qui peut s'avérer incorrecte) que l'espace de temps à chaque fois est plus grand, (que par exemple entre T1 et T2 il y'a une différence de 97 secondes mais qu'entre t8 et t9 la différence est bien plus grande ce qui signifie normalement qu'on a eu besoin de plus de temps après pour ajouter 2ml qu'en début de réaction et que donc techniquement la vitesse de formation de I2 diminue? Sinon, pour étudier la cinétique d'une réaction, on nous a toujours dit qu'on procédait à un dosage, et apparemment dans cet énoncé on procéde à une technique différente, est-ce quelqu'un peut-il m'expliquer le procédé exactement ? ^^' ce n'est pas très clair pour moi (que fait-on, comment calcule-t-on le temps nécessaire à la formation de I2 à chaque fois etc etc). Et finalement, qu'est ce qui se passe au niveau du volume et de la concentration du thiosulfate après plusieurs ajouts de thiosulfate ? Du volume total également. Merci d'avance et excusez ce message un peu trop long. ^^"
-----



 )
)
