Bonjour,
Je doit trouver les équations de réaction pour la préparation de CuCl2 et je doute sur quelques points.
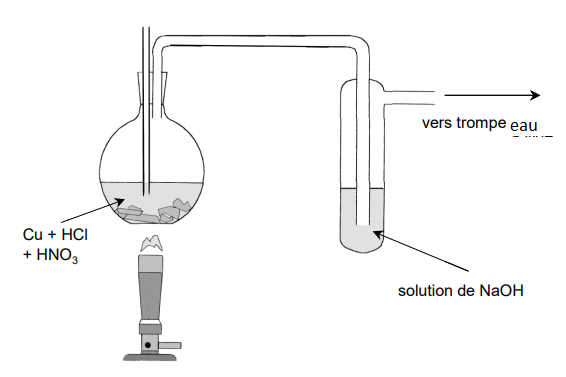
Notre montage est le suivant :
Mode opératoire:
Dans un ballon contenant de la tournure de cuivre on introduit un volume de HCl.
Puis 5mL de HNO3 concentré à ce moment la solution prend une teinte verdâtre dû à un début de formation de Cu2+ qui dans HCl devient vert car solvaté par les Cl-.
On chauffe la solution devient de plus en plus verte et on observe la formation de NO2 gaz roux dans l'enceinte du "bécher" remplit de soude.
Or on a aussi un gaz vert dans l'enceinte du ballon apparemment ce serait aussi du NO2.
Mais du coup qu'elle est l'utilité de la soude? Éviter que de l'eau entre dans le ballon ?
Notre montage comporte une trompe à eau permettant d'apporter plus d'oxygène dans le milieu car l'oxygène accélère la réaction.
C'est là que je ne suis pas sur. L'oxygène accélère la réaction parce qu'il permet aussi d'oxyder le cuivre ??
O₂ + 4H⁺ + 4e⁻↔ 2H₂O E°=1.23 V
Cu ↔ Cu2+ +2e⁻ E°=0.34 V
Et du coup je ne trouve pas d'autre couple de potentiel que NO3- / NO2
Donc comme nous on a HNO3 et que c'est la forme protonné de NO3- je remplace.
On devrait avoir: HNO3 + 1e- + H+ ↔ NO2 +H2O E°=0.8 V
Est-ce bien cette réaction qu'on a avec HNO3 ?
Cu + 2HNO3 + H+→ Cu2+ + 2NO2 + 2H2O
Une fois tout le cuivre dissous on verse la solution obtenue dans un bécher qu'on chauffe pour obtenir CuCl2.
Pourquoi chauffer ? Je me suis dis que c'était pour évaporer l'eau ? et que CuCl2 se forme
Merci !!
-----