Bonjour,
J'ai quelque difficulté à résoudre cette exercice, est-ce que quelqu'un serait m'expliquer quelle méthode faut-il utiliser ?
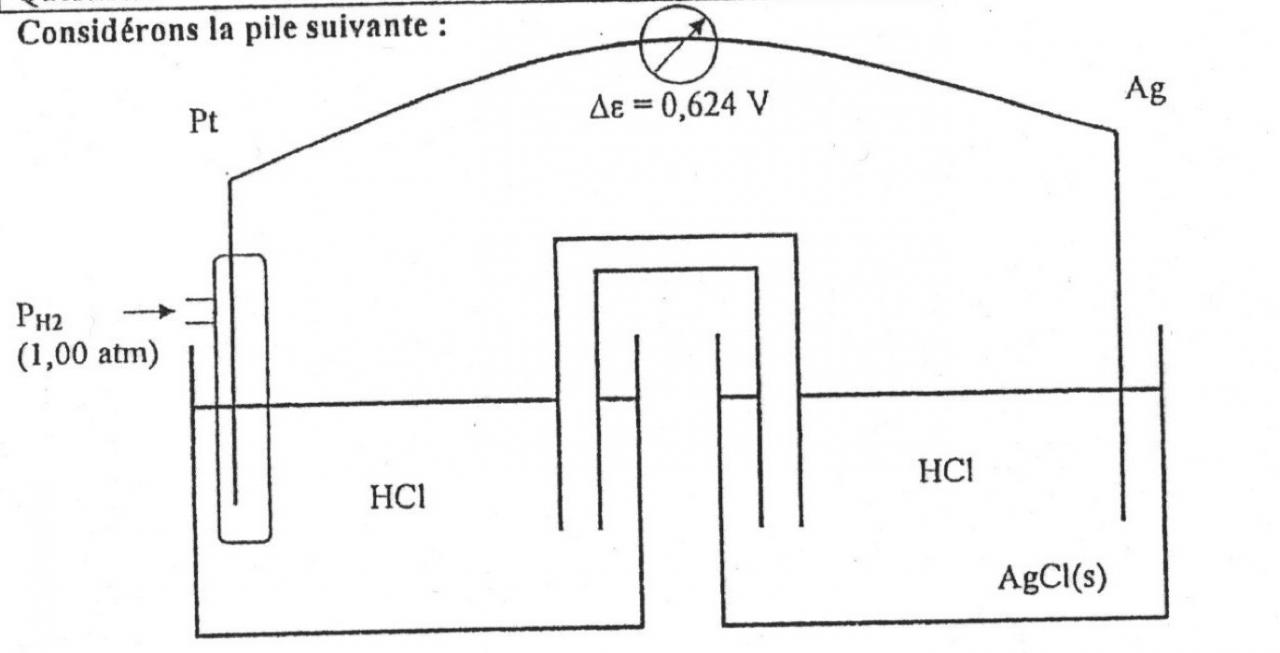
Voici l’énoncé :
Sachant que le fem de cette pile vaut 0,624V à 25°C, quel est le pH de la solution de HCl ?
La bonne réponse est 3,4
Dans un premier temps, j'ai commencé par écrire les couples qui sont (Ag+/Ag et H+/H2) ensuite j'ai écrit leur demi-réaction pour avoir la réaction complète qui est 2 Ag+ + H2 --> 2 Ag(s) + 2H+ puis j'ai utilisé l'équation de Nernst ce qui me donnait 0,624 = 0,8 - (0,0592/2) x log (H+ ^2) mais je tombe qui concentration totalement aberrante... J'ai même songé à utiliser les produits de solubilité dans l'eau pour le AgCl mais alors dans ce cas là il me manquait la valeur de la concentration de Cl- . Je suis bloqué là
D'avance merci.
-----