Bonjour,
je m'intéresse à l'électrolyse en vue d'effectuer un dépôt sur une pièce métallique ( zincage, dorure...) avec l'objectif d'effectuer le minimum de tests pour trouver les conditions en vue d'un dépôt de bonne qualité.
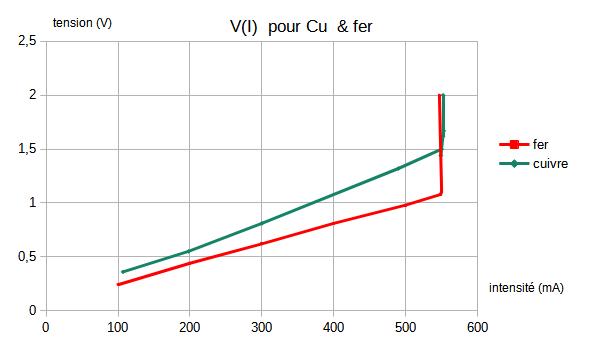
Lors de tests préliminaires, j'ai relevé la courbe V(I) et je souhaiterais savoir si elle est d'un intérêt quelconque pour choisir le point de fonctionnement optimum et si non quelle approche faut-il suivre
.
Par ailleurs la littérature cite le" potentiostat" qui permet le tracé de courbes intensité-potentiel. Ce dispositif utilise une 3ième électrode permettant certainement de faire des mesures précises, mais dont je comprend pas bien l'utilité si on ne s'intéresse qu'aux conditions à réunir pour réaliser un dépôt métallique de qualité.
nota : pour y voir plus clair, j'ai déjà testé pour le zincage du chlorure de zinc, sur du cuivre et du fer sans comprendre comment optimiser les paramètres en jeu. A terme pour la dorure, ce sera une solution AuClH3 avec une cathode en graphite et la pièce métallique ' anode ) sera du laiton ou du cuivre.
-----