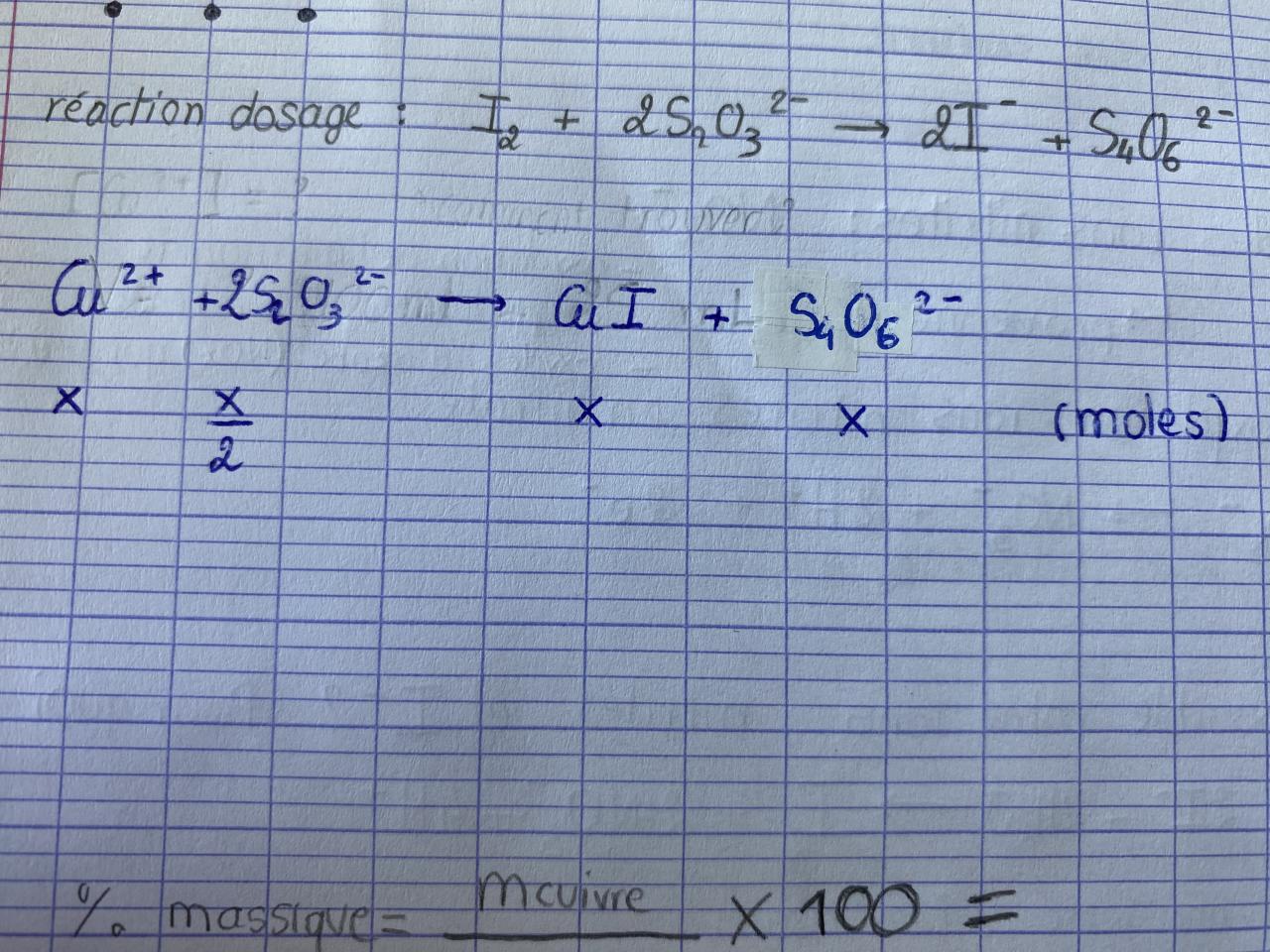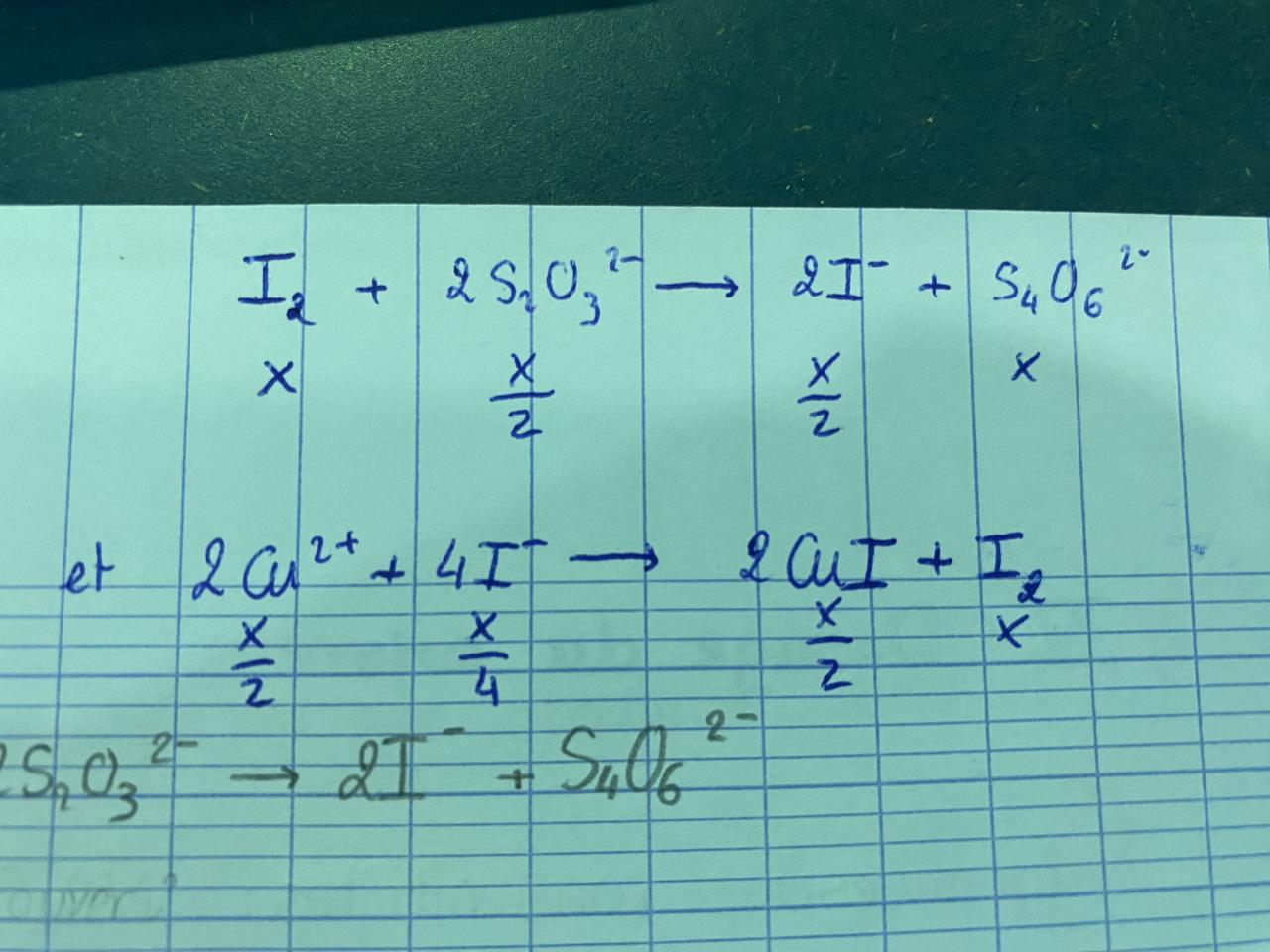Bonjour à tous!
Je suis en train de préparer un futur TP de chimie minérale et il y a deux questions où j’ai un doute.
Je vous mets ci-joint le sujet afin que ça soit plus simple de lire l’énoncé!
783322B1-DE58-420F-BB9B-37C4F643B7AA.jpg6436B783-55CF-460C-BB7B-2DD6498703B9.jpgB0095866-CD90-4274-A71F-5BA9F1C14B0A.jpg
Voici mes questions:
Partie 3
Déterminer le nombre de moles de précipité obtenu et son incertitude. En déduire le nombre de moles de nickel dans le bêcher puis dans la fiole
=> Comme à la fin de cette manipulation on pèse le précipité (dans la masse du verre fritte bien sûr) on aura: n=m/M
avec une incertitude sur la masse (et le volume du bêcher où est l’alliage ?)
C’est après que j’ai un doute: pour le nombre de moles de nickel dans le bêcher puis la fiole.
Je ne vois pas comment faire… Est-ce que la quantité de matière reste la même? (Il y aura juste les incertitudes de volume de la fiole du coup?)
Et pour rappel: %massique nickel = (mnickelobtenu/m alliage) .100?
Partie 4
Calculer le nombre de moles de Cu2+ dans le bêcher puis la fiole (avec incertitude)
=> Alors là aucune idée je suis totalement perdue…
Pour le reste j’ai tout trouvé je ne bloque que sur ce type de question.
En vous remerciant d’avance pour votre aide!
-----