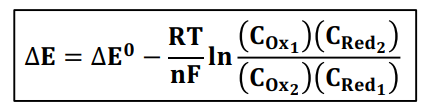Bonjour je suis bloqué dans un exercice, j'ai mis l'énoncé en fichier joint. J'ai réussi à faire l'exercice A) mais pour calculer la différence de potentiel je suis légèrement bloqué. J'ai essayé de faire cela à l'aide de l'équation de nernst voici les détails de mon calcul = 0.65 - (8.31*298/6*96500)*ln(((10^-3)^2)/1.5*0.794) mais j'ai l'impression qu'il y a quelque chose qui cloche avec mes concentrations, je ne sais pas si cela est dû au volume de 0.5L que je n'ai pas pris en compte dans mes calculs ou du ph de 0.1 que j'ai mal représenté.
Votre aide me serez précieuse, merci pour votre temps et je vous souhaite à tous une excellente journée !

-----