Bonjour à tous! Je suis en train de préparer un futur TP de chimie macromoléculaire: nous n’avons eu qu’un seul cours définissant les polymères donc autant vous dire que je ne comprends pas grand chose au TP avec toutes ces formules dedans!
On me demande de faire une démonstration dans la première question qui, j’espère, me permettra de comprendre les autres questions.
Voici l’énoncé pour la première question:
«*La polymérisation du styrène est amorcée par l'azobisisobutyronitrile (AIBN) à la température T = 70°C. L'avancement de la réaction est suivi par DILATOMETRIE.
Cette méthode est basée sur le fait que la masse volumique du monomère est plus faible que celle du polymère, et de ce fait la polymérisation s'accompagne d'une contraction de volume ΔV.
La quantité de polymère formé est proportionnelle à ΔV = S × Δh (avec S = section
du capillaire de diamètre intérieur 3 mm et Δh = variation de niveau dans le
capillaire entre le temps t = 0 et le temps t).
Démontrez que :
ΔVp = -d[M]/dt = (1/(M0.V0.γ)).S. (Δh/Δt)
avec M0 = masse molaire du monomère
V0 = volume initial de styrène
γ = coefficient de contraction = 1/d1 - 1/d2
d1 = masse volumique du styrène = 0,860 g/cm3 à T = 70°C
d2 = masse volumique du polystyrène = 1,046 g/cm3 a T = 70°C
d = masse volumique du styrène = 0,909 g/cm3 à T = 25°C*»
Je suis complètement bloquée, ça serait super si quelqu’un peut m’expliquer svp!
-----



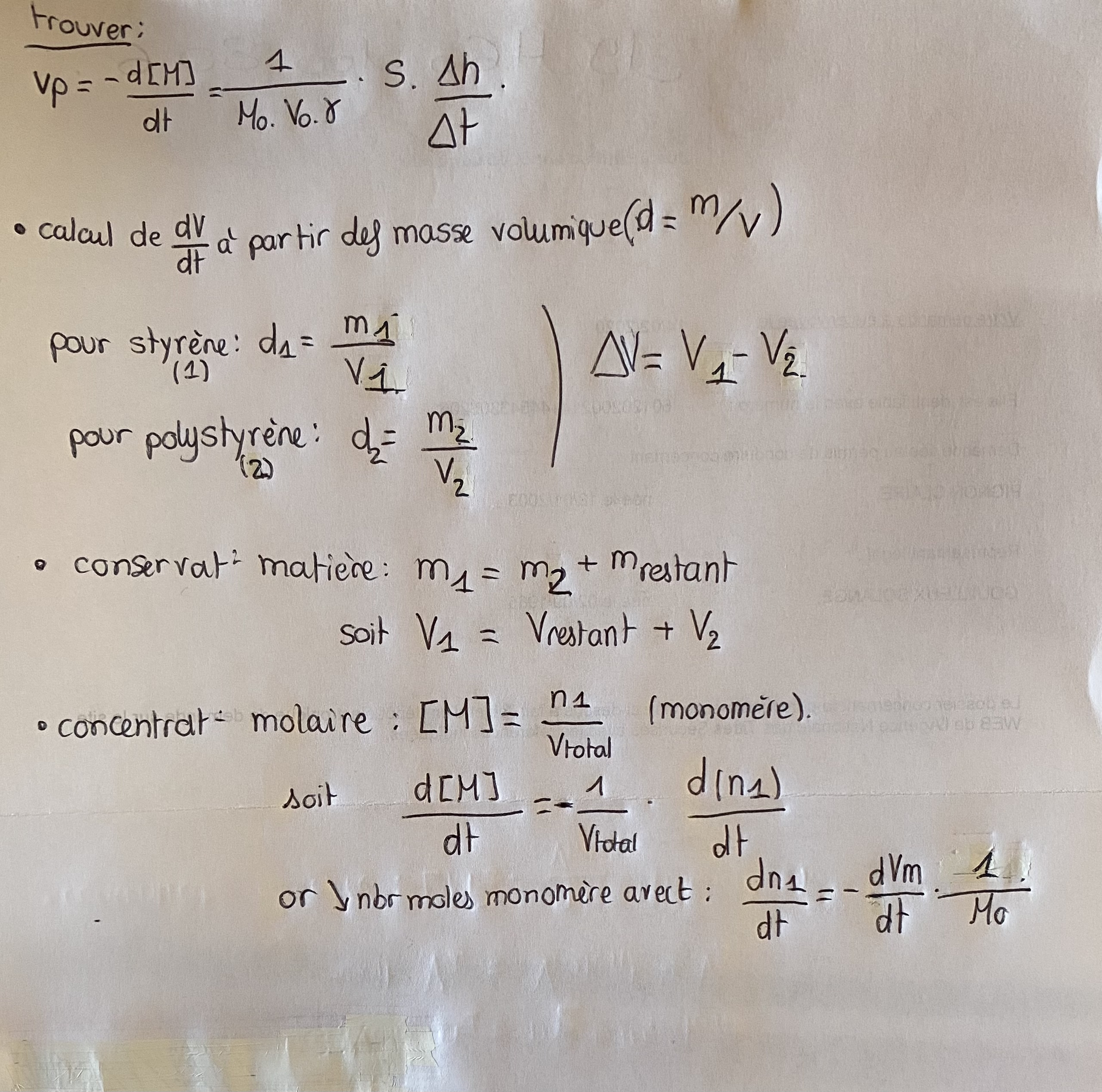

 ;
; 