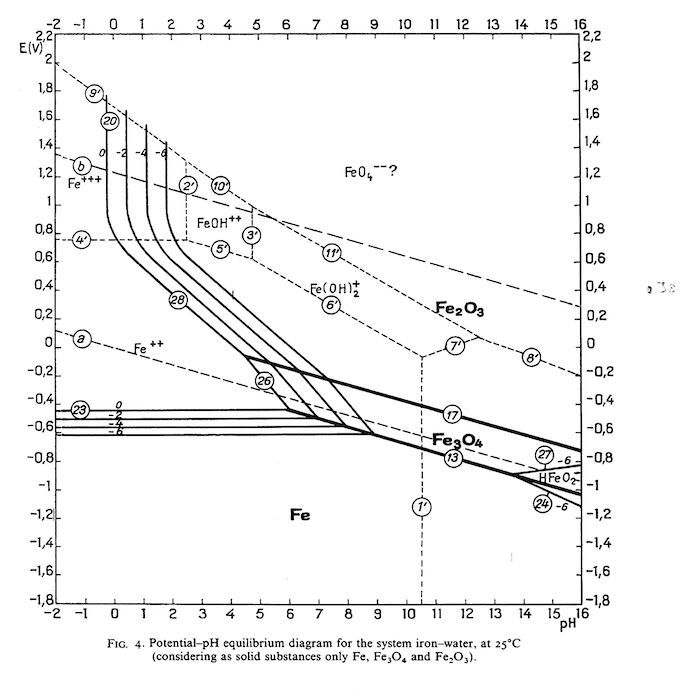
Bonjour à tous,
Je cherche à adapter un algorithme qui permet de générer des diagrammes de pourbaix des alliages Fe-Cr-Ni dans l'eau.
Certaines des réaction ne dépende pas de l'échange d'électrons donc je ne peux pas utiliser l'équation de Nernst pour déterminer la zone de prédominance à chaque cas.
Par exemple dans le cas de la réaction 2Fe3+ + 3H2O -> Fe2O3 + 6H+
Je ne suis pas sûr de faire le calcul du pH d'équilibre de la réaction correctement.
J'ai à ma disposition des données thermodynamique sur l'énergie libre de formation des espèces à 25°C.
Avec dGf0(Fe3+) = -1100, dGf0(Fe2O3) = - 177400, dGf0(H2O) = -56687, en cal/mole
On sait que la constante d'équilibre K s'écrit K = [Fe2O3][H+]^6 / [Fe3+]^2[H2O]^3
On peut écrire [Fe2O3] = [H2O] = 1 car l'activité du solide et de l'eau = 1
Et on sait que K = exp(- dG0/RT)
Donc pour trouver le pH d'équilibre de la réaction cela revient à [H+]^6/[Fe3+]^2 = exp(-dG0/RT) avec pH = - log10[H+]
donc -6pH - 2log10([Fe3+]) = exp(-dG0/RT) <=> pH = -1/6*(exp(-dG0/RT) + 2*log10[Fe3+])
Peut on calculer dG0 simplement comme dG0 = dGf0(Fe2O3) - (-2*dGf0(Fe3+) - 3 * dGf0(H2O)) = -177400 + (2200 + 3*56687) = - 5139 cal/mol = -21,501 kJ/mol ?
cela revient à exp(-dG0/RT) = 1,0087 et en prenant [Fe3+] = 10^-6 le résultat donne pH = -1/6 ( 1,00871 + 2*log10(10^-6)) = 1,83
Je me demande juste si mon raisonnement est correct ?
Pour réussir à retracer les diagrammes qui m'intéressent j'ai à ma disposition les équations de réactions chimiques et d'oxydo-réduction (pour lesquelles je peux utiliser l'équation de Nernst), les valeurs de G° pour les différentes espèces à différentes température et S°(25).
Merci beaucoup par avance pour vos réponses et bonne fin de journée !
-----