Bonjour,
j'essayais de faire un exercice pour m'entraîner en thermo et je bloque sur un exo qui me pose problème, voici l'énoncé :
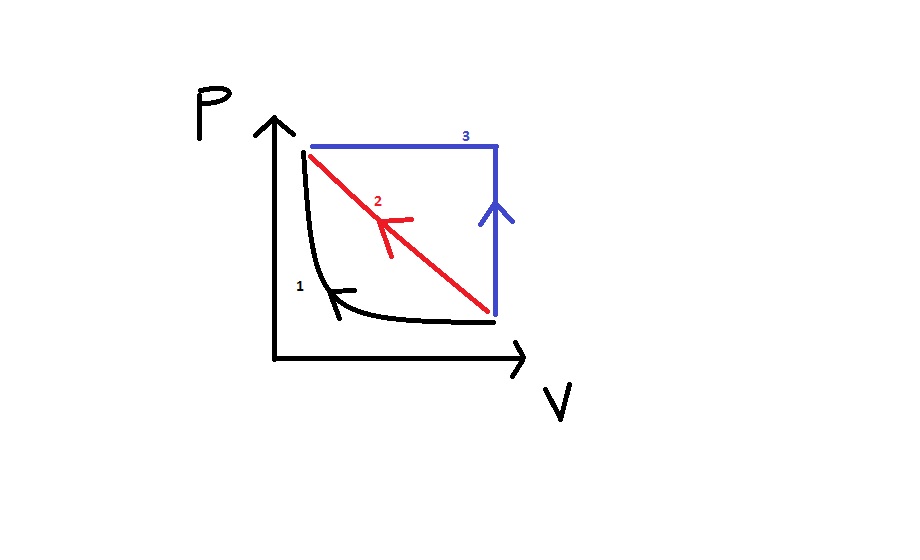
"On considère deux moles de dioxygène, gaz supposé parfait, que l’on peut faire passer réversiblement de l’état initial A ( PA , VA , TA )
à l’état final B ( PB = 3 PA , VB , TB = TA ) par trois chemins distincts :
1. chemin A 1 B : transformation isotherme ;
2. chemin A 2 B : transformation représentée par une droite en diagramme de Clapeyron (P , V ) ;
3. chemin A 3 B : transformation composée d’une isochore puis d’une isobare.
Représenter les trois chemins en diagramme de Clapeyron.
Calculer dans chaque cas les travaux mis en jeu en fonction de TA .
TA = 300K"
Alors en pièce jointe je vous ai mis mon diagramme avec les trois chemins, je pense que les chemins 2 et 3 ne sont pas corrects, mais je ne vois pas sinon comment ils seraient...
Et ensuite pour le travail du chemin 1, je fais W1 = intégrale de (-P dV) = -2 RT A intégrale de (dV/V) et puis je trouve W1 = 2 R TA ln 3.
Par contre les chemins 2 et 3 je ne vois pas du tout comment procéder...
Est ce que quelqu'un pourrait m'aider s'il vous plait ?
Merci d'avance !
-----




