Bonjour à tous,
Dans le cadre d'un dossier pédagogique je suis amené à réaliser quelques schémas. (le niveau de ces dossiers est grossièrement celui d'un étudiant de 1ere année donc ni grand public ni expert, entre les 2)
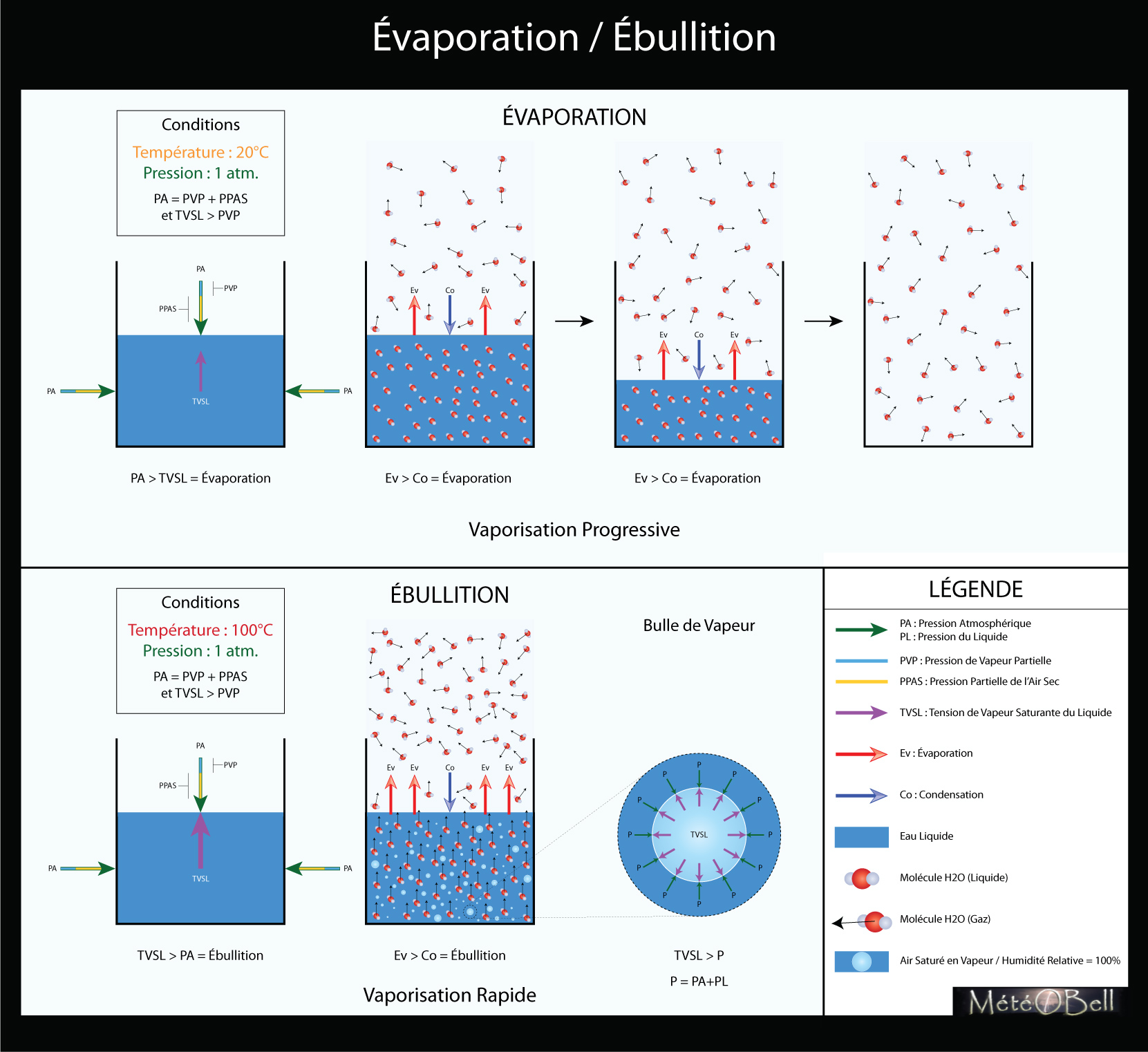
Le chapitre de ce dossier traite des hydrométéores que l'on trouve dans l'atmosphère et dans ce cadre je suis amené à définir d'abord quelques notions élémentaires : vapeur d'eau, évaporation, ébullition, condensation, pression de vapeur etc...
Je n'ai aucun mal à les définir par texte, par contre quand il s'agit de réaliser un schéma à la fois clair et précis, ça se complique toujours un peu.
J'ai comme une vague impression que je fais une erreur de raisonnement mais j'ai beau me triturer l'esprit, je n'arrive pas à voir exactement où ni comment y remédier.
ebullition_evaporation.jpg
pression_vapeur.jpg
A noter que mon prochain schéma concernera l'humidité relative, et en particulier lorsque la pression de vapeur partielle est égale à la pression de vapeur saturante du gaz (air), ce qui ici n'est donc pas représenté.
J'aurais voulu aussi mettre en schéma la surébullition (bien que je sors du cadre de mon dossier), mais je n'arrive pas à bien cerner comment je pourrais les représenter sur mes schémas.
En vous remerciant d'éventuelles corrections
Cordialement
-----



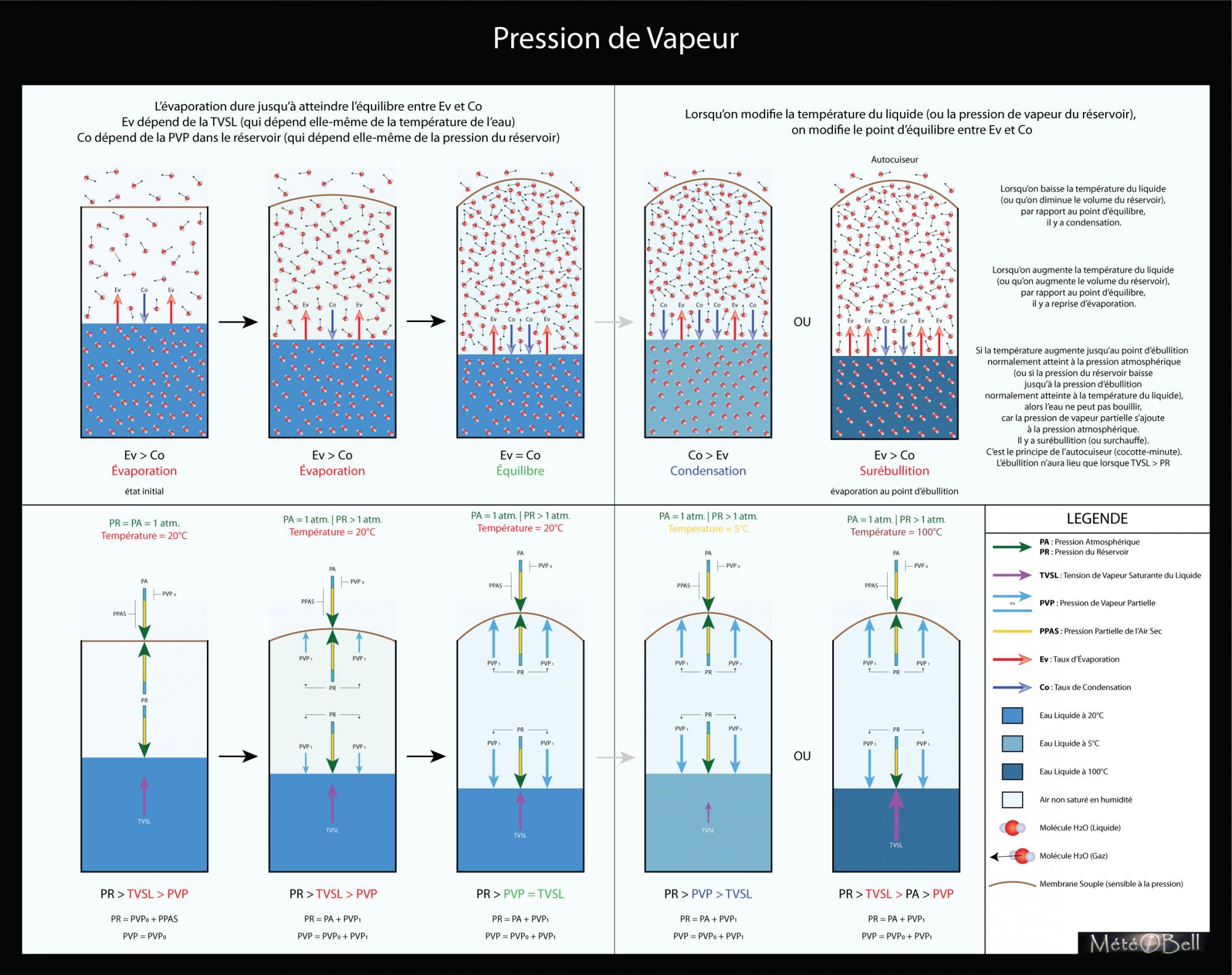

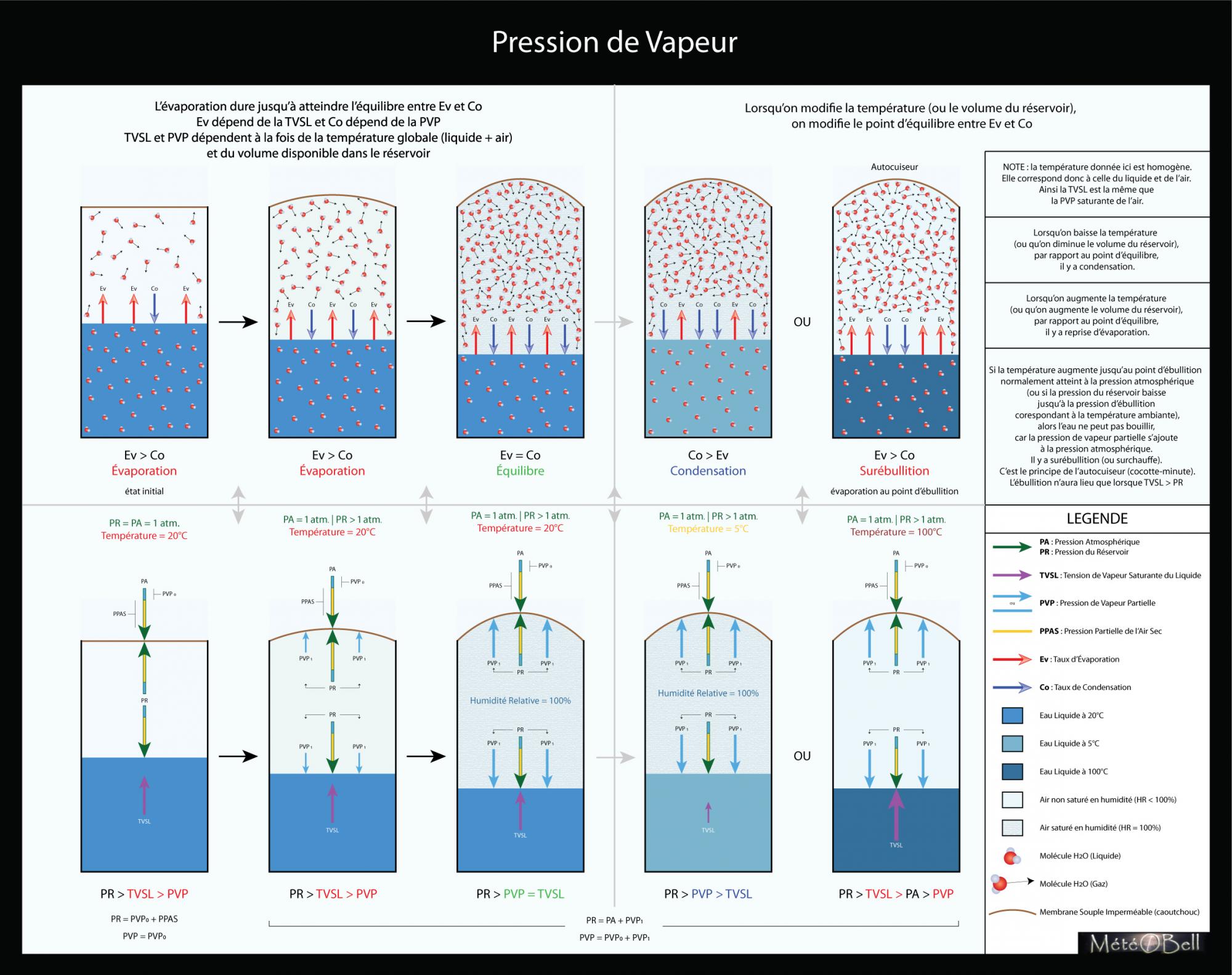
 Hophop je passe à un autre schéma...
Hophop je passe à un autre schéma... 