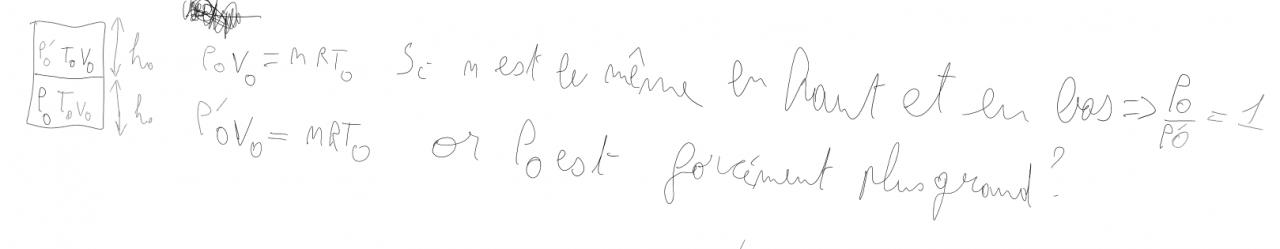Bonjour j'ai un exercice à faire dans le cadre d'un TD de thermodynamique je ne pense pas pouvoir avoir une réponse clair d'ici demain, mais tempis voici l'intitulé :
J'ai donc essaie de traiter cet exercice mais je me trouve bloquer car on ne nous donne pas S j'ai trouver sur ce forum une discution sur ce même exercice mais qui n'apporter pas de réel réponse : https://forums.futura-sciences.com/p...questions.html
En effet à la fin du poste une des deux personnes dit qu'il manque une donner alors qu'une autre dit qu'elle as la solution merci de m'éclairer je peu transmettre ce que j'ai essayer de faire si nécessaire.
-----