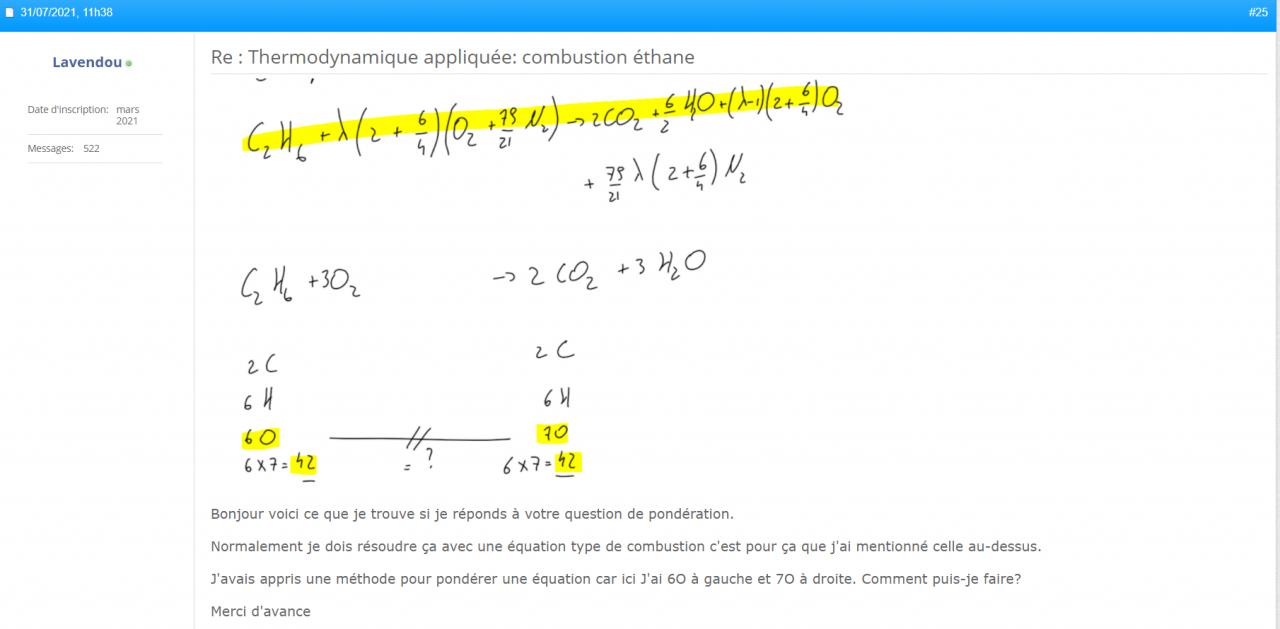
Vous parlez bien de cette équation parce que celle du 25 n'est pas correctement pondéré.
Du coup je dois calculer le nombre de mole de produits totales? Soit 2 moles de C2H6 deviennent 10 moles de produits, ça fait 1 mole de C2H6 devienne 5 moles de produits?
Sauf que C2H6 réagit avec un autre réactif pour avoir 10 mole de produits?
Quel coéfficient dois-je prendre?
-----






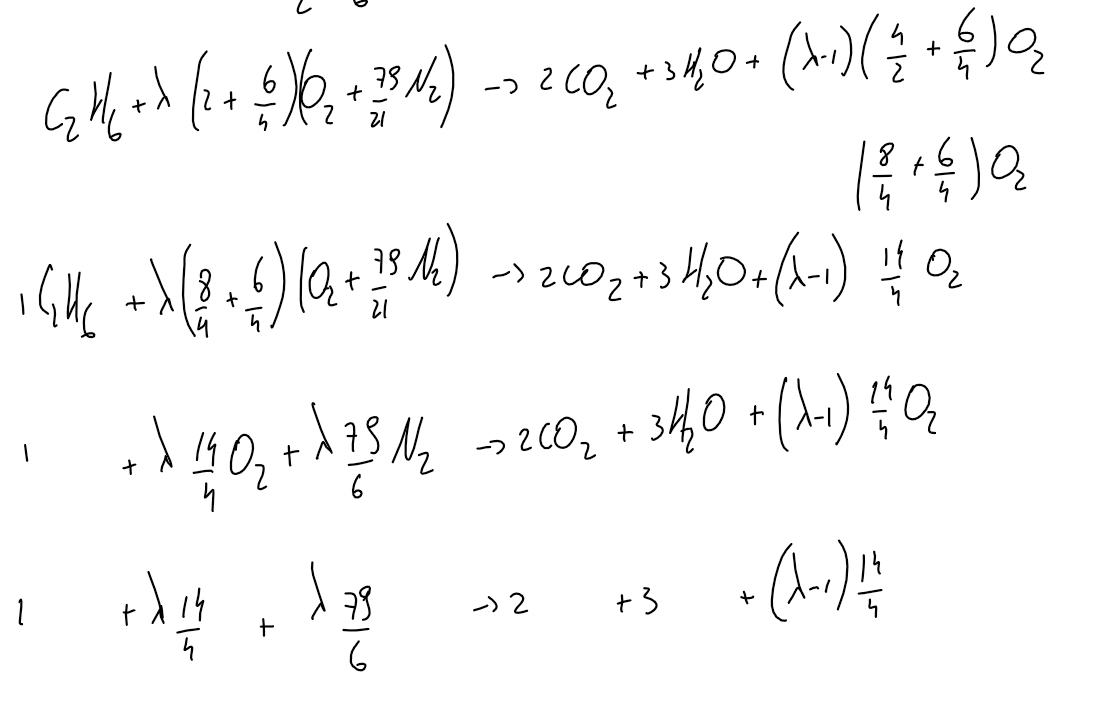

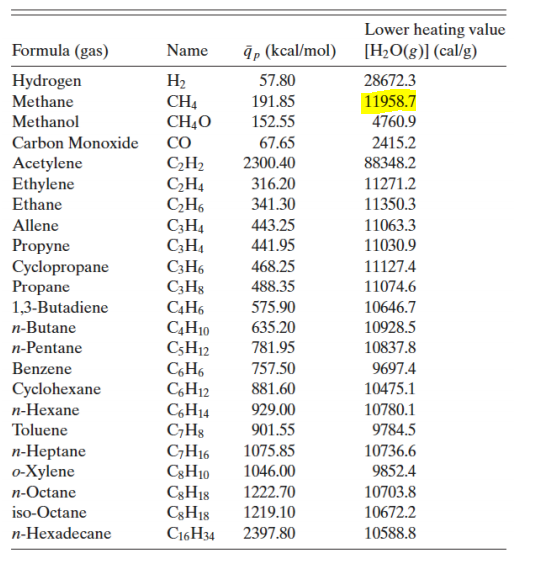
 avec une seule inconnue Tsortie donc, on peut calculer Tsortie.
avec une seule inconnue Tsortie donc, on peut calculer Tsortie.

