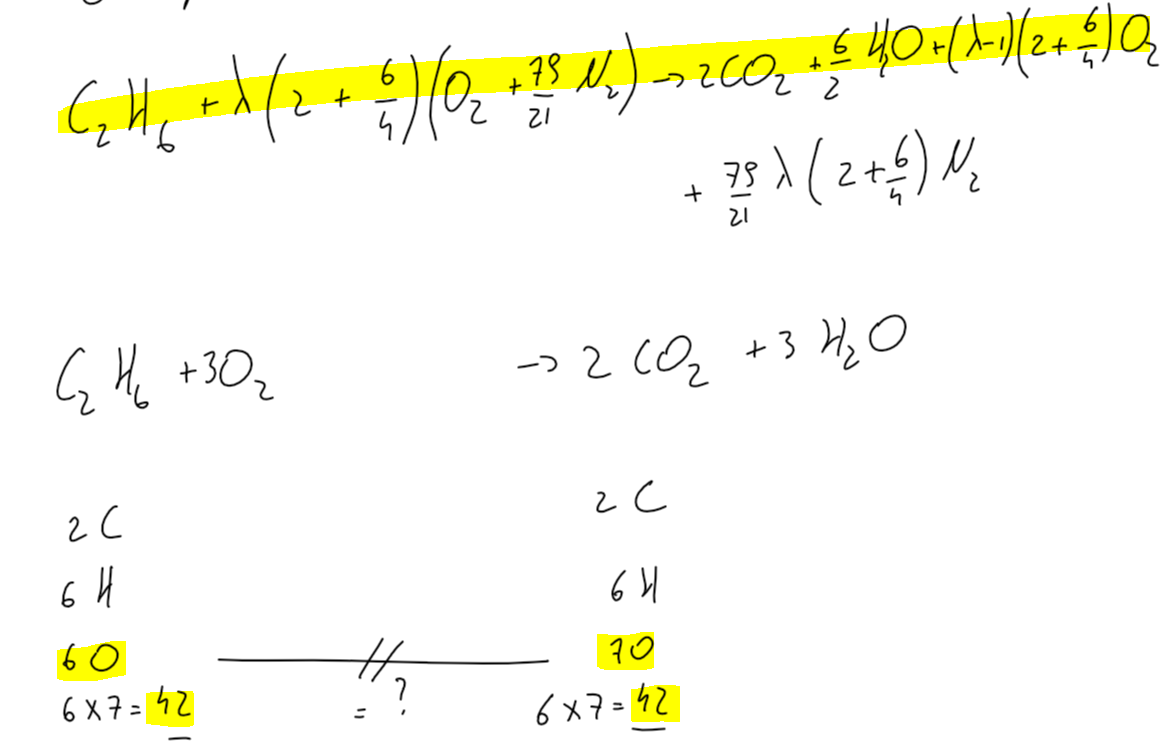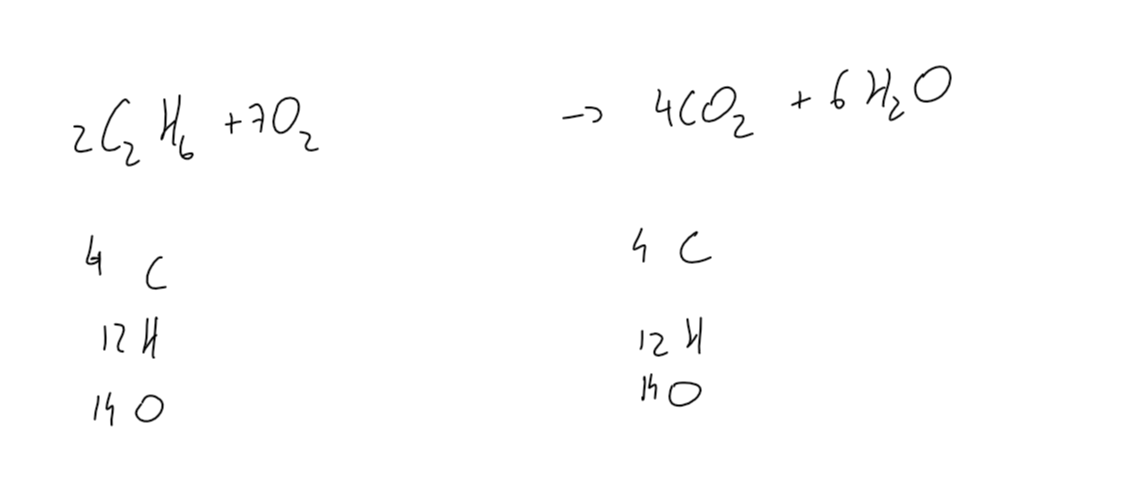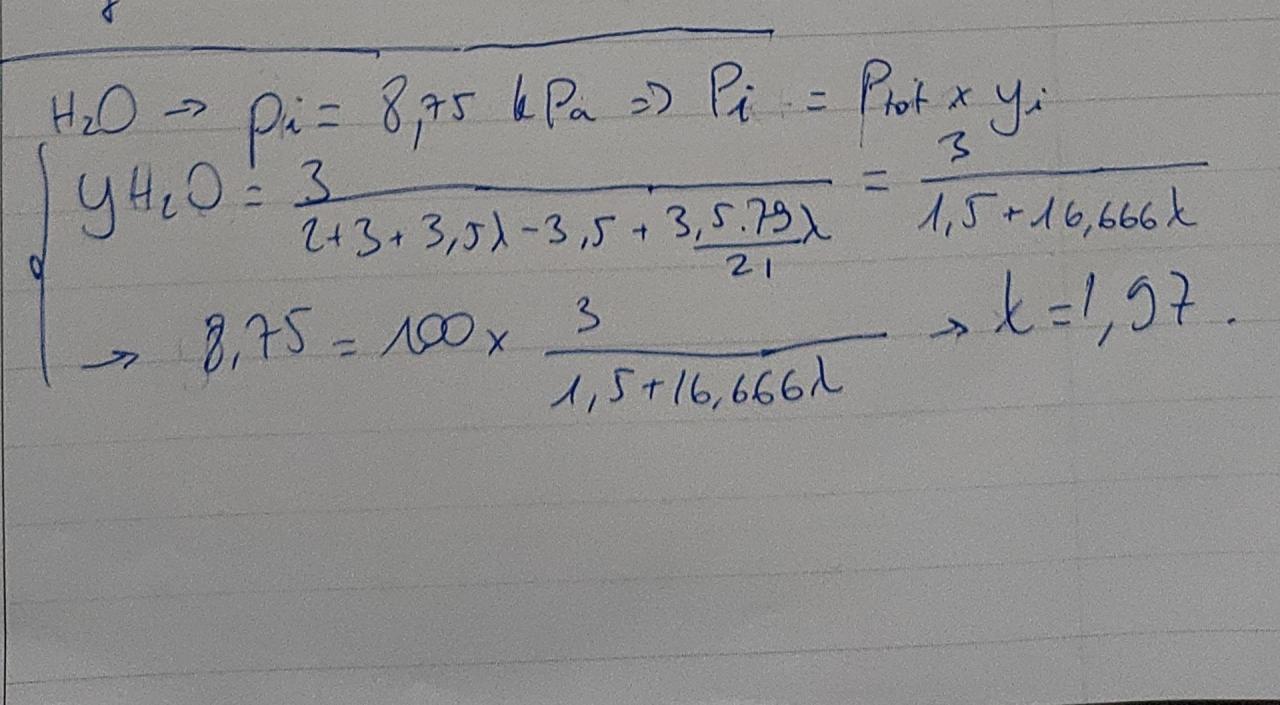Bonjour,
Ici pour cette exercice la question 2, on me demande de calculer lambda (coéfficient d'excès d'air)
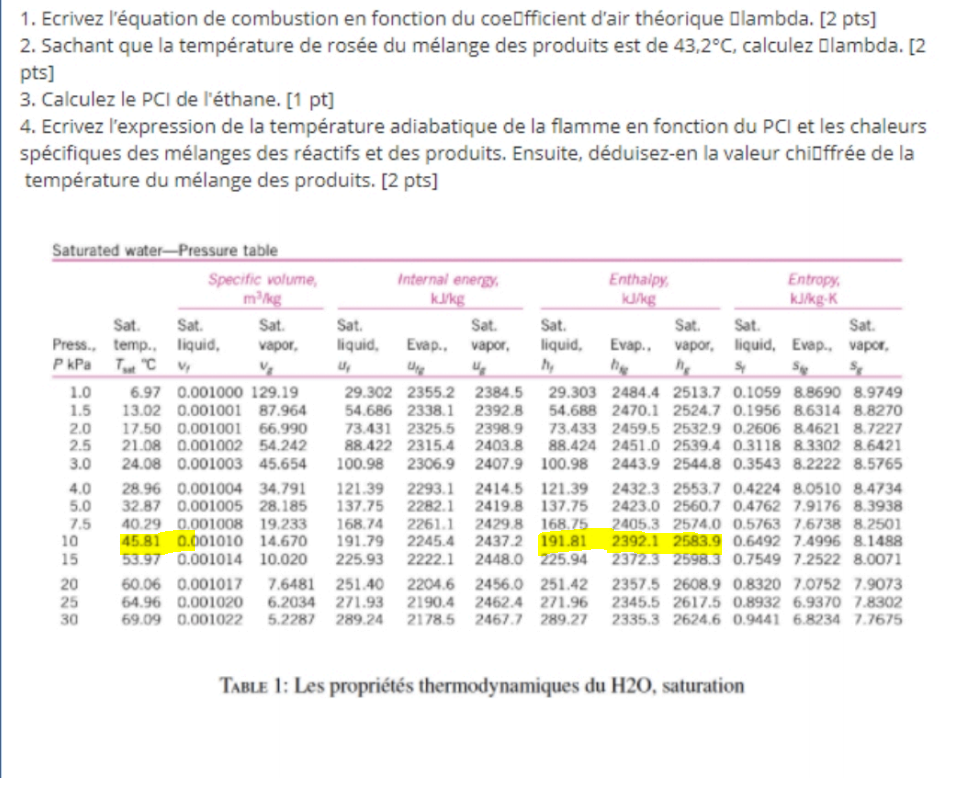
Vous pouvez voir ici ma réponse pour la première question sur lambda et la réaction de combustion de l'éthane.
Voici l'énoncévv.PNG
Voici mon réaction de combustion avec lambda vvv.jpg
Le problème c'est que dans mon cours on parle de PCI, Tad mais on ne peut parle pas du calcul de lambda vu que celui-ci est en général donné?
Pouvez-vous m'aider?
-----