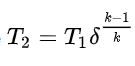Bonjour,
J'ai de très petites bases en physique et c'est loin d'être un terrain connu pour moi : Je cherche à connaitre la température de 2 réservoirs de d'hydrogène après transvasement. Malheureusement je n'ai pas trouvé mon bonheur sur de précédents post.
Assez naïvement j'ai supposé l'enthalpie constante et simplement fait une détente isenthalpique sur le premier réservoir (pour commencer). Bon je retrouve bien que l'hydrogène chauffe à la détente mais ce n'est pas ce qu'on observe dans la réalité.
j'ai donc considéré le travail fourni par l'hydrogène en me basant sur ce que j'ai pu lire sur wiki :
https://fr.wikipedia.org/wiki/Travail_de_transvasement
En appliquant la formule dans le chapitre "loi polytropique"
avec k= Cp/Cv = 1.41 (environ) je trouve qu'une détente de 400 bar à 200 bar fait chuter la température du gaz de 20°C... à -33°C ! Ca me semble foireux. est ce parce que ce n'est pas un gaz parfait?
j'ai essayé de calculer le travail et de le soustraire a l'enthalpie finale mais ca donne un résultat équivalent.
Je pense que je me suis trompé et/ou que je ne comprend rien et j'ai besoin d'un guide.
Merci d'avance pour votre aide
-----