Bonjour j'ai un probleme pour trouver la concentration Ca d'une solution d'acide benzoïque :
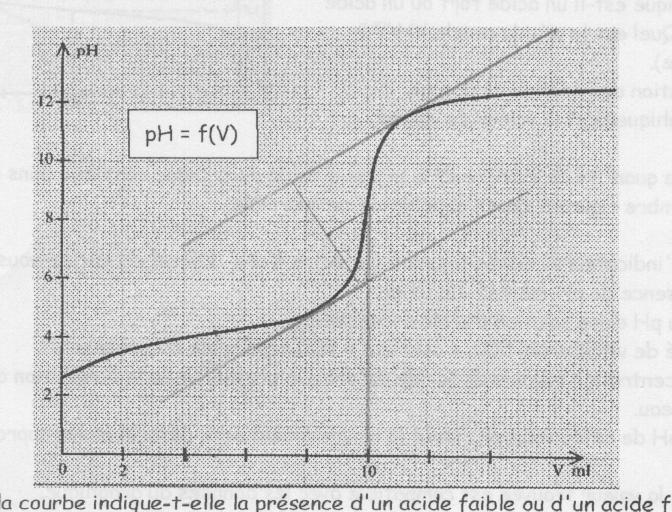
1) l'allure de la courbe indique t'elle un acide fort ou faible??
La courbe donne l'allure d'un acide faible
2)trouver graphiquement la valeur du pKa de l'acide doser d'apres ces acides suivant :
acide méthanoïque Ka = 1,7*10^-4
acide éthanoïque Ka = 1,8*10^-5
acide propanoïque Ka = 1,4*10^-5
acide benzoïque : Ka = 6.3*10^-5
Réponse : on sait que pour un acide faible Ph = pka a la demie equivalence
Pka = 4,2 ( lecture graphique )
Or Ka = 10 ^- Pka donc Ka = 6,3*10^-5 donc on dose l'acide benzoïque
4) On étudie la solution initiale a ¨Ph = 2,6
a) écrire l'équation de réaction de cet acide avec l'au puis faire un tableau d'avancement.
C6H5COOH + H2O = C6H5COO- + H30+
EI Ca ecxé 0 0
EF Ca- y ecxé y y
b) calculer Ca:
Ka = [C6H5COO-]* [H3O+] / [C6H5COOH]
Ka = y²/Ca- y
Ca= y²*Ka / y [H3O+] = 10^-Ph = 10^-2,6 = 0.0025 mol/L= y
don Ca = (0.0025)²*(6,5*10^-5) / 0.0025
Ca = 1,625*10^-7 mol/L
Or si je verifie avec la formule Ph = pka-log (Ca) je trouve un Ph de 11..
j'ai refais 3 fois le calcul et je trouve pas mon erreur... est ce que quelq'un pourrait m'aider svp??
merci d'avance
-----