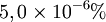Bonjour! j'ai du mal avec un certain exercice de chimie portant sur le pourcentage massique,en voici l'énoncé:
On pèse 100mg de glucose C6H12O6
données: masse atomique C=12,H=1,O=16
Quel est le pourcentage massique du carbone dans l'échantillon?
Merci d'avance pour votre aide
-----







 ou
ou