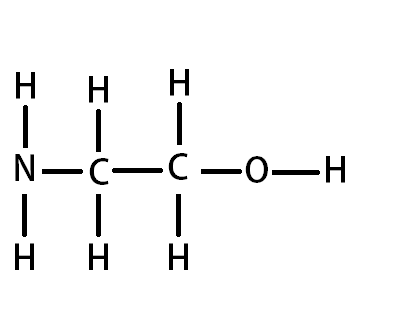
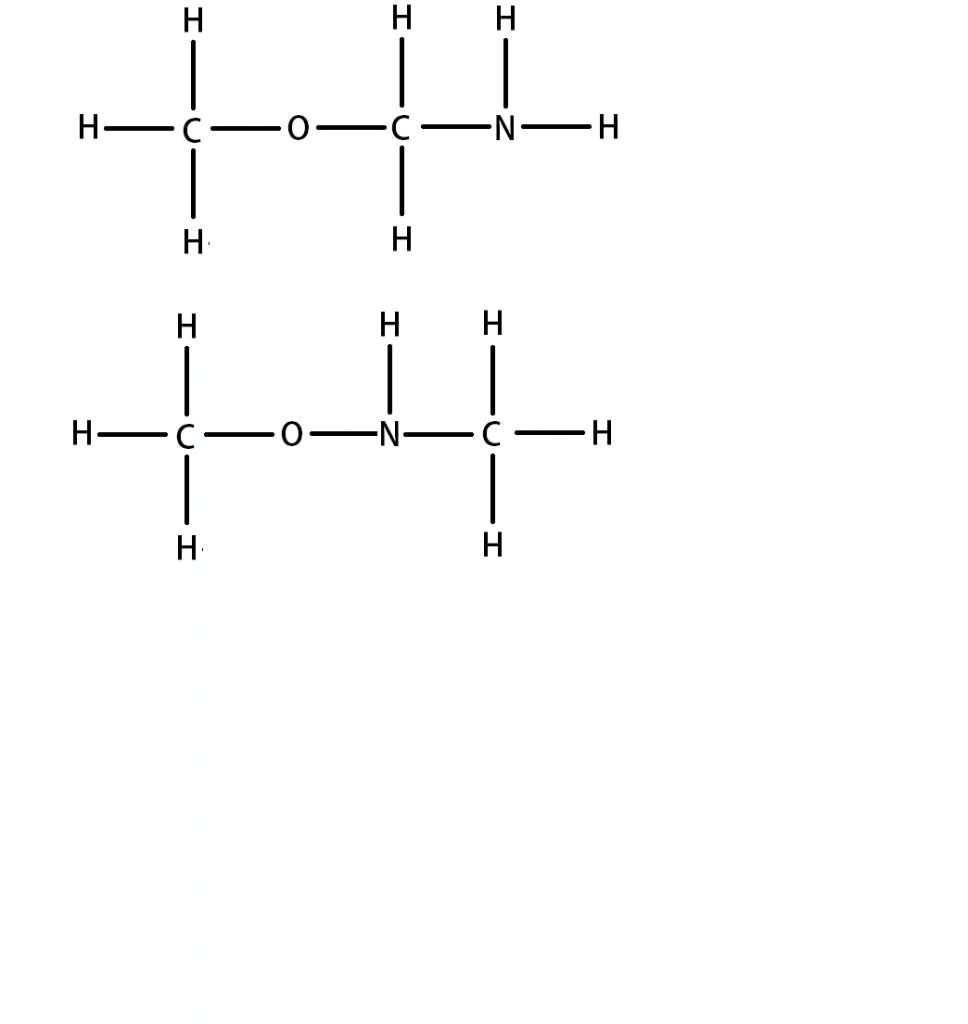
Bonjour,
Voila , en chimie , il y a une notion que je ne comprends pas , celle des liaison covalentes : j'ai un exercice , ou on me demande : combien d'électrons chaque atome doit t-il engendrer dans les liaison covalentes pour satisfaire la règle de l'octet . Je ne peux pas vous en dire plus car après sa serait de la triche , mon problème c'est que je ne comprend pas ^^ c'est quoi les liaison covalentes et qu'elle est le rapport avec la règle de l'octet ? Enfin je n'ai rien compris si vous pouviez m'expliquer merci
-----