Bonjour,
j'essaye de calculer la quantité d'acide qu'il me faut ajouter à une solution d'ammoniac pour atteindre un certain pH.
J'utilise la formule pH = 7+ 0,5 x (pKa + log [NH3]) et le résultat que j'obtiens ne me parait pas logique.
Fais-je une erreur de raisonnement ?
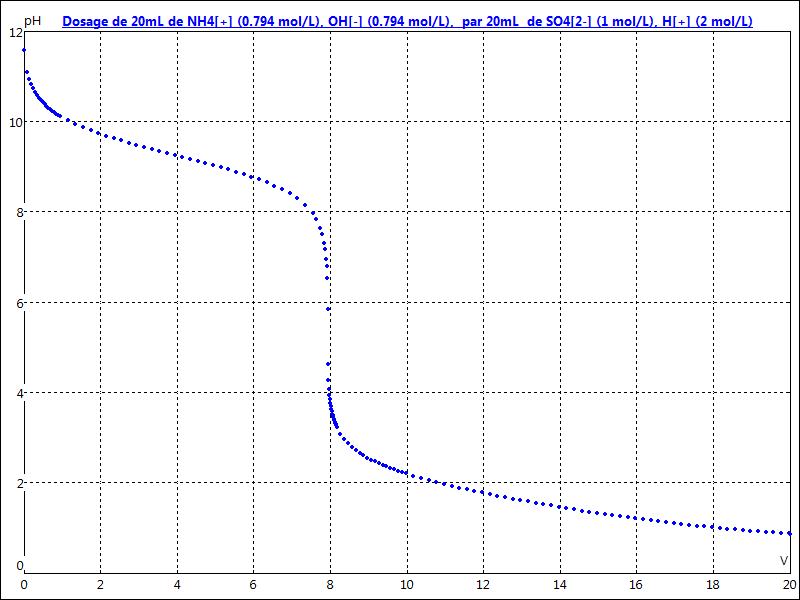
à pH 11,5 (saturation), j'ai [NH3] = 0,794 mol/L
à pH 9,2 (pKa), j'ai [NH3] = 0,004 mol/L
à pH 7, j'ai [NH3] = 25.10-6 mol/L
à pH 3, j'ai [NH3] = 2,5.10-9 mol/L
D'après ces résultats, je n'ai besoin de rajouter que très peu d'acide sulfurique pour passer de pH 7 à pH 3 dans la solution, alors qu'il en faut beaucoup plus pour passer de pH 11,5 à pH 9,2 ou 7.
Pourtant, d'après mes souvenirs de dosage acide-base, au départ on ajoute de grandes quantités de réactif jusqu'à approcher du point d'équivalence puis une goutte suffit à obtenir le saut de pH...
Où est l'erreur ?
Merci d'avance
-----





 (et accessoirement
(et accessoirement 