Bonjour, je suis en terminale S et j'aurais voulu de l'aide pour un TP de chimie sur le "dosage d'une solution de chlorure d'ammonium".
L'énoncé est le suivant :
préparation de la solution à doser.
Dissolution :
vous préparerez, dans une fiole jaugée de volume V0 (250,0 ml ou 500,0 ml selon le groupe) une solution à zéro de chlorure d'ammonium en pesant M= 0,25 g de solutés.
moi, je fais parti du groupe correspondant à un volume de 250,0 ml.
1) outre la fiole jaugée, nommé le matériel nécessaire. Rappeler les précautions à prendre.
2) déterminer la concentration C0 en chlorure d'ammonium apporté dans la solution S0.
3) une réaction totale se produit lors de la mise en solution du chlorure d'ammonium. Comment s'appelle une telle réaction. Écrire l'équation.
4) la solution de chlorure d'ammonium a un caractère acide. Parmi les espèces du couple ammoniac, ions ammonium, quelle espèce prédomine dans la solution ?
titrage :
vous effectuerez un dosage destructif en faisant réagir des ions hydroxyde sur les ions ammonium.
1) écrire l'équation de la réaction du dosage quelles sont les espèces spectatrice?
2) déterminer et calculer la constante d'équilibre associé à cette réaction. Quand déduisez-vous quant à cette réaction ?
3) définir l'équivalence. Établir, en utilisant un tableau d'avancement, la relation liant C0, Cb, V0, VbE...
4) calculer le volume VbE attendu pour l'équivalence ?
Voilà, c'est tout pour la première et la deuxième partie. À la fin de la deuxième partie, nous en sommes venus à construire un tableau qui montre comment varie le pH et la conductimétrie de la solution de chlorure d'ammonium, en fonction du volume de la solution titrante, c'est-à-dire une solution contenant des ions hydroxydes.
J'ai réussi à répondre au 1) et au 3) de la partie "préparation de la solution à doser". Pour le 2), j'ai trouvé une concentration de 4,95E-3mol/L et pour le 4), j'ai répondu que c'était l'ammonium, l’espèce qui prédominait. Est-ce correct?
Pour la deuxième partie, j'ai répondu au 1). j'ai écrit la réaction du dosage mais les espèce spectatrices sont elles l'eau et le chlorure?
je n'est pas répondu au questions 2), 3) et 4). j'ai l'impression que pour cette deuxième partie, il manque des données pour répondre au questions! Faut il se référer au tableau? Seulement, il vient après ces questions, donc logiquement non! Je vous met quand même certaine données du tableau au cas où:
La solution d'hydroxyde de sodium à une concentration de 5.0E-1mol/L
La solution titrée (250.0mL de chlorure d'ammonium)
La solution titrée a un pH de 5.38 et une conductimétrie de 2.51microsiemens/cm pour un volume d'hydroxyde de sodium vb=0mL
La conductimétrie de la solution titrée augmente fortement pour un volume Vb=10mL, le pH de la solution est alors de 10,43 et à une conductimétrie de 2.14 microsiemens/cm
je suis en vacances, donc que je suis disponible à tout moment. Merci de bien vouloir m'aider, et n'hésitez pas à me réclamer des données éventuellement manquantes. Je vous joins en images, la courbe représentative du PH et de la conductimétrie, en fonction du volume Vb, le volume d'hydroxyde de sodium.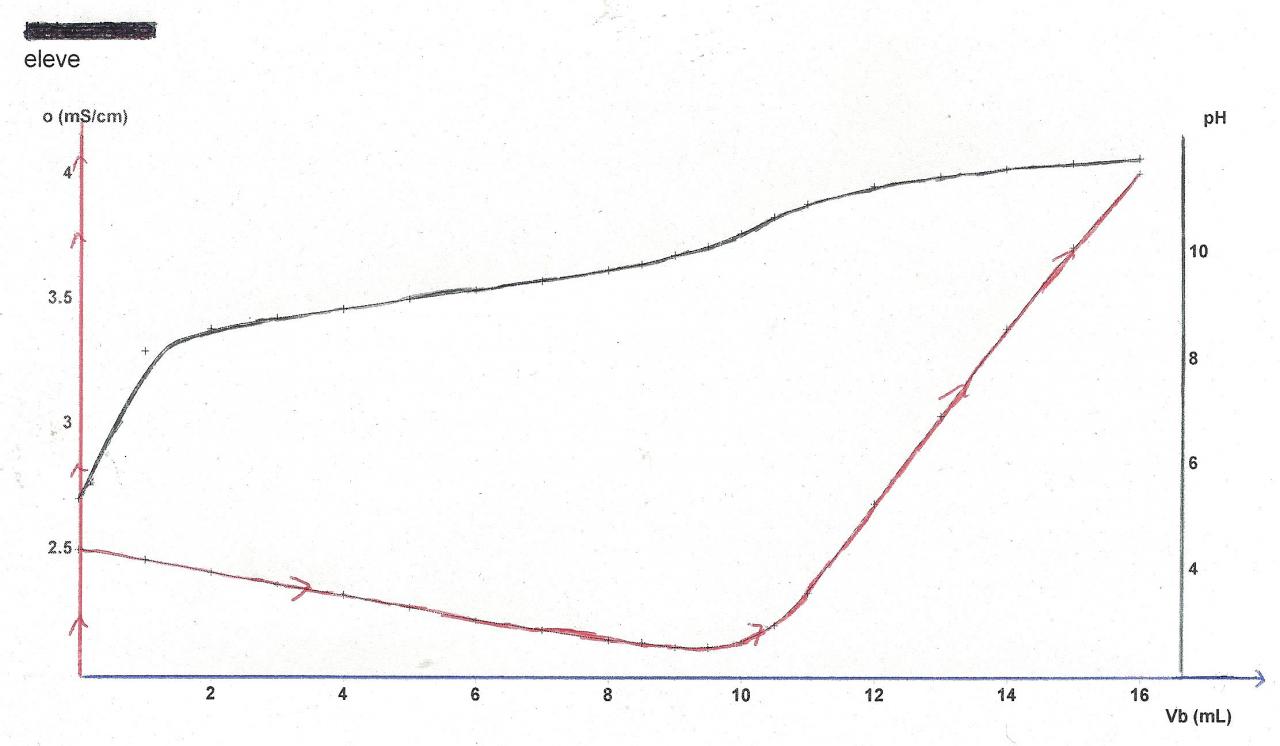
-----





