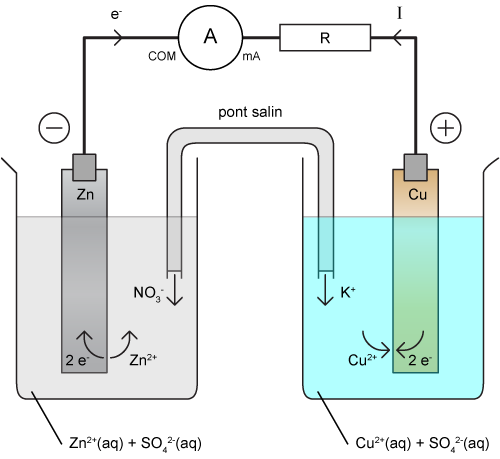
Bonjour,
Je suis en première S et je souhaiterais avoir quelques explications sur le fonctionnement de la pile Daniell :
Dans le bécher de gauche, le bout de Zinc libère des ions Zinc Zn2+ et 2 électrons. Mais pourquoi ? Par quoi ce phénomène est-il causé ? Est-ce que les ions SO42- de la solution dans laquelle la barre de Zinc est plongée joue-t-elle un rôle ?
Ensuite, pourquoi les électrons se déplacent-ils dans le fil qui relie les deux barres de Zinc et Cuivre ?
Enfin, je ne comprends pas l'utilité du pont salin. Certes il sert à relier les deux cuves pour fermer le circuit, mais à quoi servent les ions NO3- et les ions K+ ?
Merci.
-----