Bonjour,
J'ai un exercice de chimie et j'aimerais que vous m'apportiez de l'aide, car j'en ai bien besoin.
Je vous présente l'énoncé à travers divers documents ainsi que la problématique posée.
Document 1
Les limites et références de qualité des eaux destinées à la consommation humaine, à l'exclusion des eaux conditionnées, sont définies en annexe I du présent arrêté.
doc1.PNG
Document 2
doc2.PNG
Document 3
Lorsque l'on verse une solution d'ammoniac, NH3 (aq), dans une solution contenant des ions Cu2+ (aq), on observe que la solution prend une coloration bleue intense due à la formation d'un ion complexe de formule Cu(NH3)42+ (aq), appelé ion tétraamminecuivre (II).
doc3.PNG
Document 4
doc4.PNG
Données
Couples oxydant/réducteur :
NO3- (aq) / NO(g) ; Cu2+ (aq) / Cu (s).
Problème
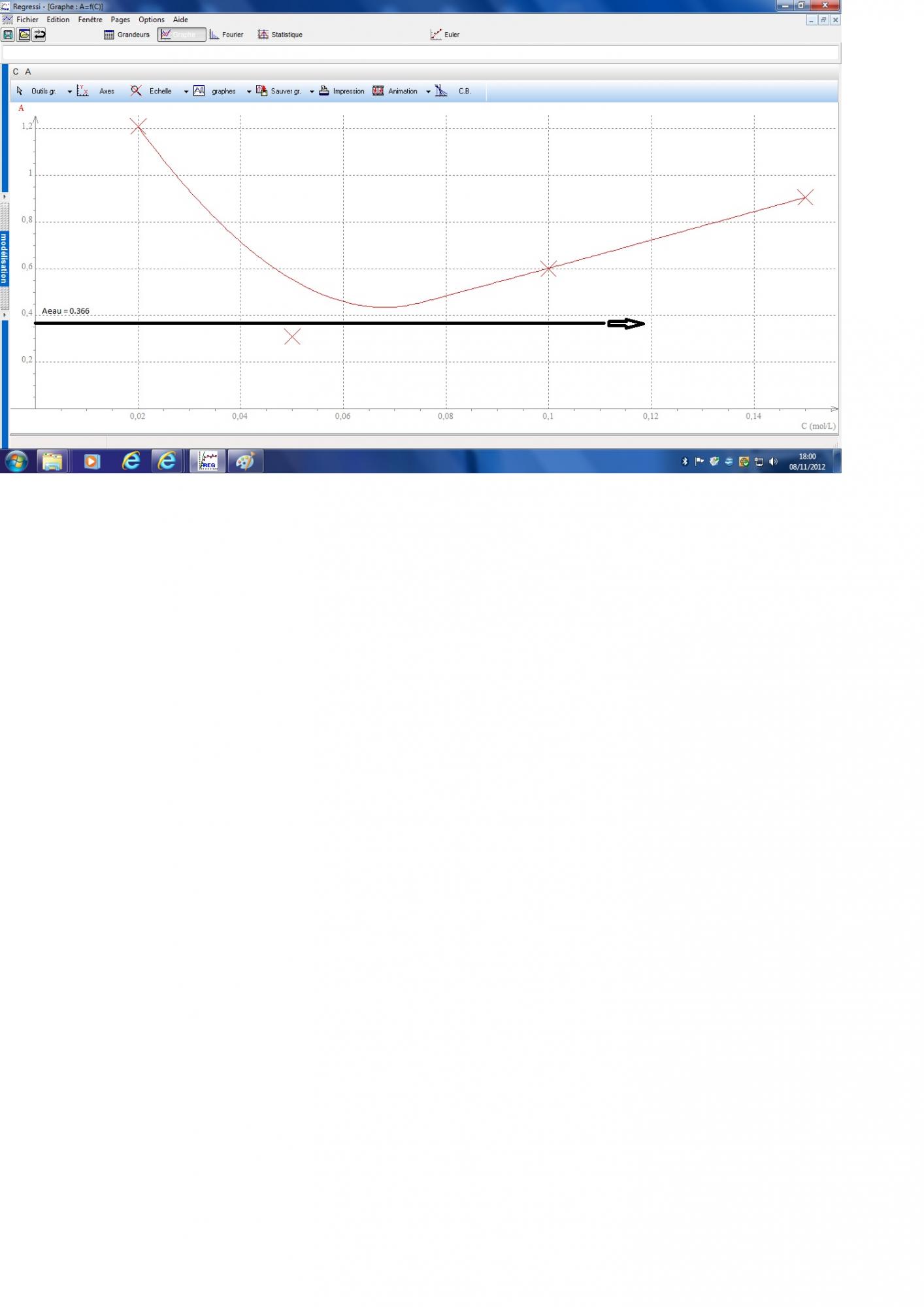
Une expérience a permis de mesurer l'absorbance de la solution S.eau : A.eau = 0,366. L'eau est-elle potable ?
C'est, selon moi, assez compliqué à résoudre.
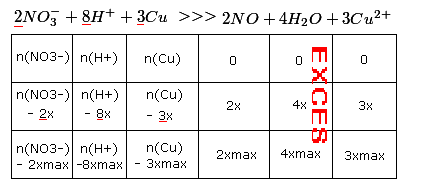
Je sais qu'il faut commencer par exploiter, de façon quantitative, la réaction entre le métal cuivre et les ions nitrate en milieu acide.
Pouvez-vous m'aider à déterminer cette réaction ?
Merci à ceux qui voudront bien m'éclaircir, et bonne journée/soirée à tous !
-----



 Pourriez-vous me dire si j'ai juste ?
Pourriez-vous me dire si j'ai juste ?