Bonjour,
j'ai un exercice :
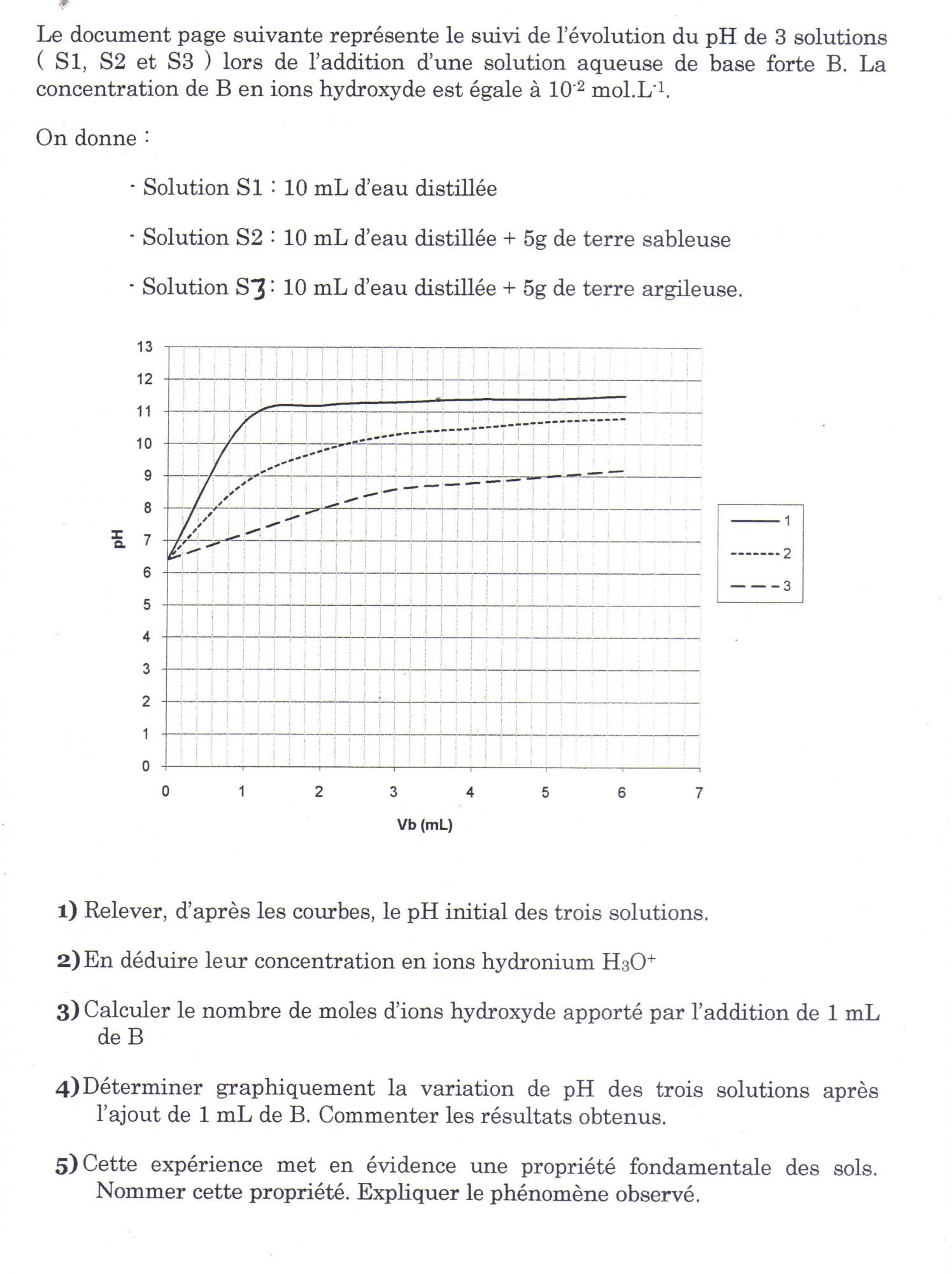
Afin de mesurer le pH d'un sol, on mélange dans un bécher 10g de terre séchée avec 25mL d'eau. Le pH mètre indique la valeur de 6,5.
Calculer la concentration en ions H3O+ (ou H+) de cette solution.
Pour calculer H+, je fais 10-pH donc : 10-^6.5 = 3.16227766E-07
est-ce bien ça ?
"On ajoute dans le bécher contenant la terre et l'eau 5ml d'acide nitrique à 0,1 mol.L-1.
Le pH passe de 6,5 à 6.
On ajoute la même quantité d'acide nitrique à 25mL d'eau pure.
Le pH passe de 7 à 1,8. "
Préciser quelle propriété du sol est ainsi mise en évidence.
J'comprends pas trop la question, hormis le fait que la solution passe d'acide à très acide (1,8)
merci pour votre aide :s
-----