Bonjour,
depuis le matin je coince sur le calcule de la charge nette. Je m'explique:
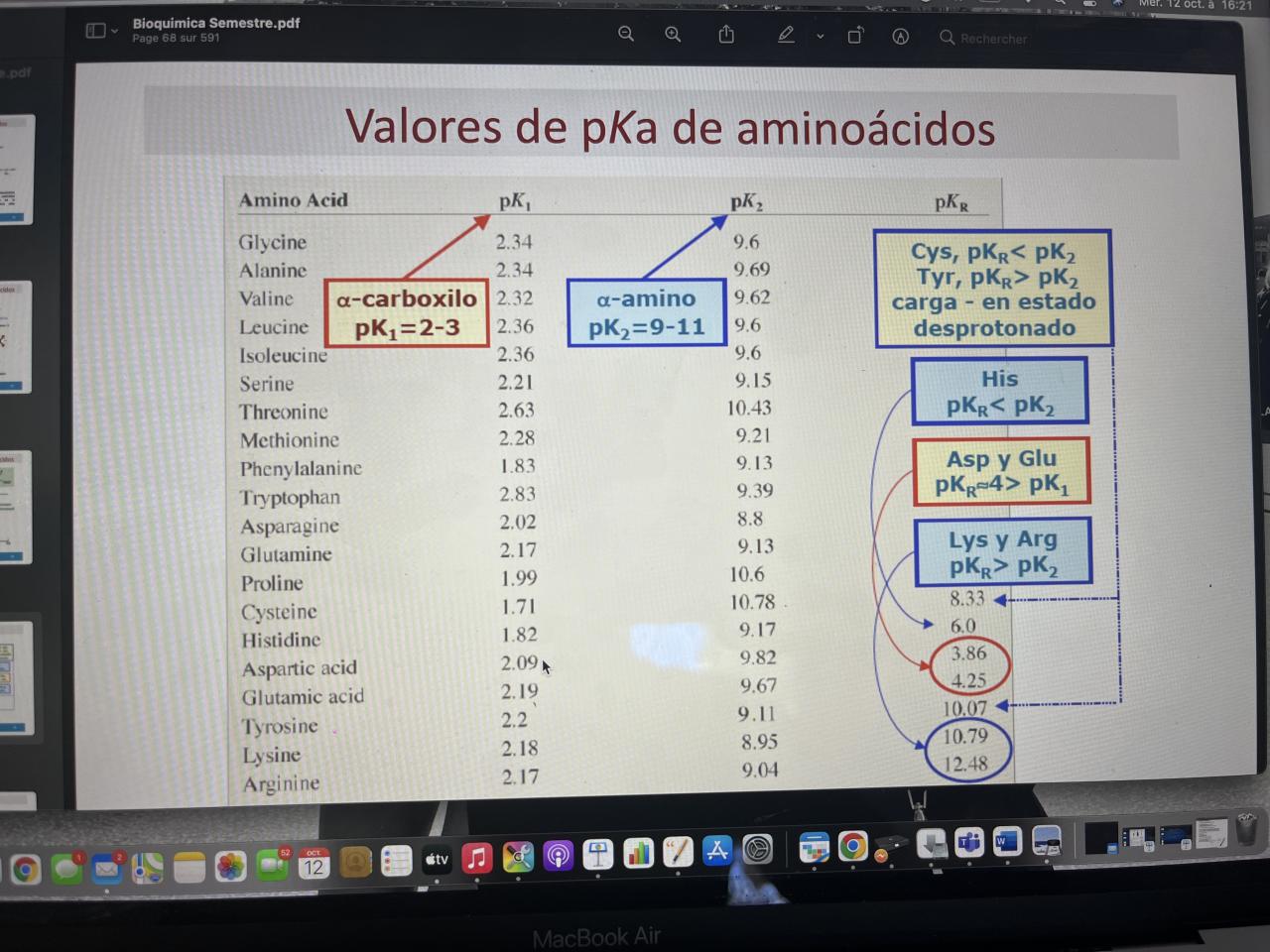
j'ai un aa qui a un NH3+ de pka 10, COOH de pka 4, COOH pka 2, NH3+ encore pka 12
on demande de trouver charge nette pour ph = 10, 4, 2 et 12.
moi j'ai fait mes calculs pour ph = 2 je trouve +2,5
ph=4 ->+0.5 ph=10 -> -0.5 ph =12 -> -2.5
en regardant la correction pour ph =2 -> +1.5 et ph =12->+1.5. donc je foire et je ne comprends pas pourquoi.
merci pour l'aide
-----