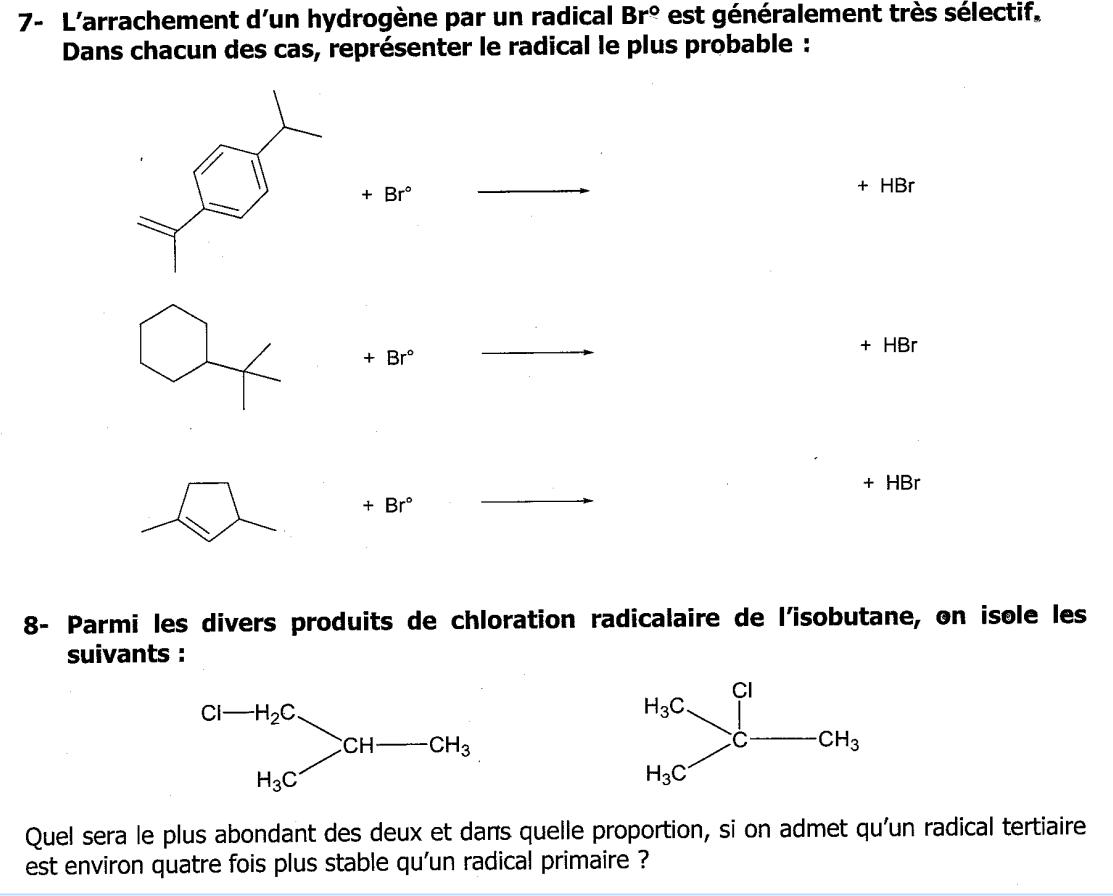
Bonsoir,
je vous contacte car j'ai quelques problèmes avec deux exercices.
le problème est que je ne comprend pas ce que l'on me demande de faire.
Pour le 7: l'espece Br va prendre un proton du composé cyclique , mais quel proton ? sous quelles conditions ? quels sont les critères de choix ?
pour le 8: on parle de radical primaire ou tertiare, mais je ne saisi pas cette notion. j'ai bien le def d'un radical: Un radical (souvent appelé radical libre) est une espèce chimique possédant un ou plusieurs électrons non appariés sur sa couche externe, mais je ne vois pas qui est qui dans cet exo ...
Pourriez-ou m'aider m'éclairer un peu ?
Je vous remercie d'avance.
-----