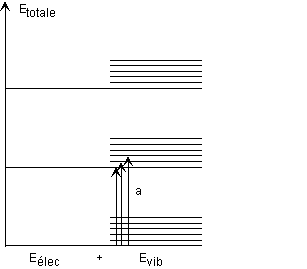
voila j'ai fait en tp le spectre UV visible du pigment de la tomate et je dois maintenant l'interpréter pour trouver la molécule !!! le probleme c'est que je n'ai pas encore fait le cours la dessus et je suis completement perdu !!! quelqu'un pourrait il me donner un tuyau ??
-----