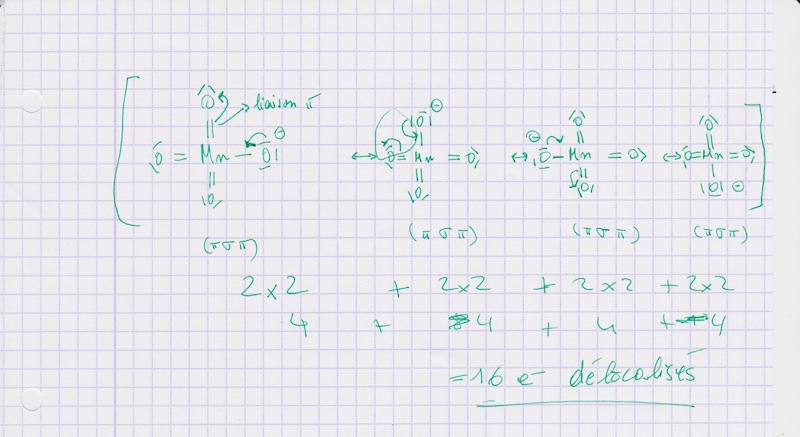Bonjour à tous,
Voici un exercice concernant l'ion permanganate MnO4-.
Mn possède 7 électrons de valence ( 3d5 4s2)
En déduire la formule de Lewis de l'ion MnO4 - (permanganate) . J'ai vérifier sur Internet et j'ai juste.
L'ion MnO4- a une structure tétraédrique avec un nuage d'électrons délocalisés. Combien d'électrons sont présents dans ce nuage ?
Je sais pas du tout comment répondre et justifier. J'aurais dis 6 électrons car l'ion permanganate possède 3 doubles liaisons mais j'aurais aussi peu-être dis 1 seul électrons car il est chargé une fois négativement. Je sais que le benzène en a 6 donc j'hésite...
Merci d'avance.
-----




 Donc si j'ai 4 formules mésomères différentes, j'ai 4 électrons dans ce nuage ? C'est ce qui se passe ici ?
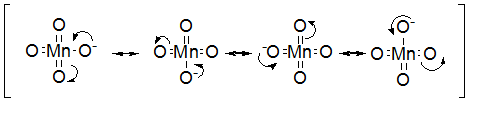
Donc si j'ai 4 formules mésomères différentes, j'ai 4 électrons dans ce nuage ? C'est ce qui se passe ici ?  Sur le permanganate tu as trois liaisons Mn=O et une liaison Mn-O-. Pour trouver les formes mésomères, tu peux "rabattre" le doublet non liant de l'oxygène portant la charge négative et ensuite "rabattre" un doublet de la laison pi d'une double liaison Mn=O sur l'oxygène afin de former un nouvel oxygène portant une charge moins. Tu peux ensuite refaire la même chose avec le doublet non liant de l'oxygène précedent portant la charge moins une autre liaisons Mn=O. Et refaire encore la même chose avec la dernière liaison Mn=O. Il y a donc plus que 2 doublets qui peuvent être délocaliser.
Sur le permanganate tu as trois liaisons Mn=O et une liaison Mn-O-. Pour trouver les formes mésomères, tu peux "rabattre" le doublet non liant de l'oxygène portant la charge négative et ensuite "rabattre" un doublet de la laison pi d'une double liaison Mn=O sur l'oxygène afin de former un nouvel oxygène portant une charge moins. Tu peux ensuite refaire la même chose avec le doublet non liant de l'oxygène précedent portant la charge moins une autre liaisons Mn=O. Et refaire encore la même chose avec la dernière liaison Mn=O. Il y a donc plus que 2 doublets qui peuvent être délocaliser.