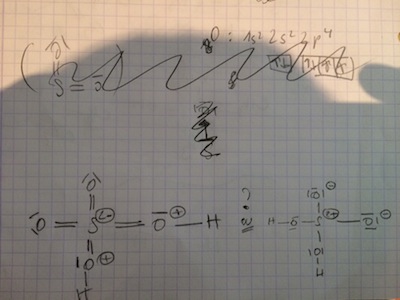Bonjour à tous,
Dans un exercice fait en classe on me demandait d'écrire deux formes de l'acide sulfurique H2SO4 .
Une devait obligatoirement inclure des charges (liaison dative) même si elle n'était pas probable.
Pour celle sans charge je n'ai pas eu de problème cependant pour celle avec les charges j'ai pas fais comme le prof et je ne comprends pas pourquoi c'est faux.
Voici ce que j'ai fais : S lié à 4 O chargé 2 fois positivement ; deux des O chargé une fois chacun négativement (triples doublets non liants) et tous les O sont liés par une liaison simple au S
Le prof à mis comme correction : tous les O sont doublements liés au S donc c'est le S qui est chargé deux fois négativement !
Comment savoir laquelle est juste ? Car pour moi la mienne est 'plus correcte' puisque l'oxygène (O) a tendance à se chargé négativement [voir ion sulfate].
J'espère que c'est +/- clair ... Pas facile d'expliquer sans schéma sous la main :/
Merci d'avance
-----