Bonjour,
Alors j'ai un petit soucis avec l'exercice ci-joint.
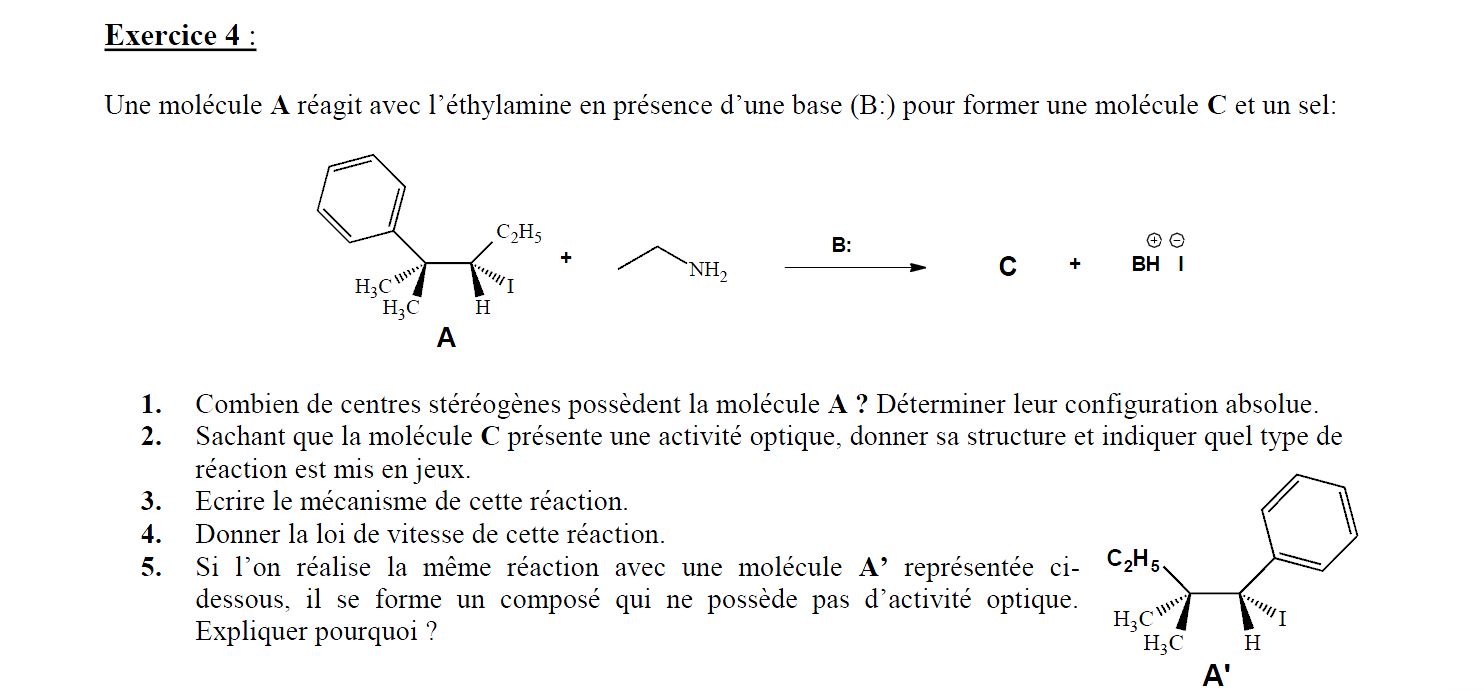
On me demande le mécanisme et j'ai tendance à penser que c'est une E2, car on a deux réactifs, du coup pour moi la vitesse de réaction est V = k[Ethylamine][Base],
mais l'halogène I n'est pas en position anti-périplanaire avec le groupement avec lequel il doit s'éliminer.
Donc je ne vois pas qu'elle est la bonne réponse.
De plus on nous dit que le produit C est optiquement actif, dans le cas d'une E1, on a la règle de Zaitsev, du coup normalement les deux produits formés ne sont pas produit en 50/50 et il y
aurait activité optique, mais dans le cas d'une E2, on a qu'un seul produit formé et c'est également optiquement actif, et du coup je ne vois pas non plus comment répondre à la dernière question.
Pour moi on peut faire une E2 pour A', car on a les deux groupements qui "s'éliminent" en position anti-périplanaire, mais je ne vois pas pourquoi le produit ne présenterait pas d'activité optique.
Merci d'avance pour votre aide !
-----