Bonjour,
Voila je bloque sur un exo et j'aurais besoin d'aide SVP!
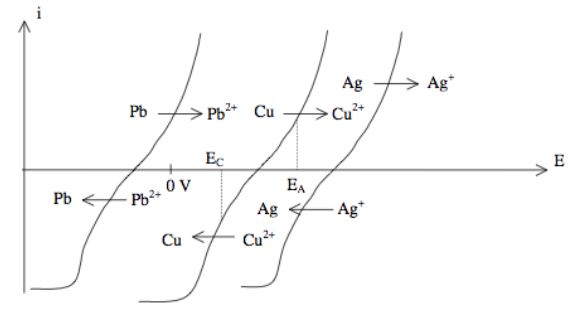
Le raffinage électrolytique du cuivre consiste à placer du cuivre impur comme anode dans une solution concentrée de sulfate de cuivre. Une électrode support (en acier inoxydable) est placée en vis-à-vis pour y déposer le cuivre par réduction cathodique. Les seules impuretés contenues dans l’anode de cuivre sont le plomb Pb(s) et l’argent Ag(s). Les courbes intensité-potentiel relatives aux différents couples en présence sont représentées ci-dessous. EA désigne le potentiel auquel est portée l’anode et EC celui de la cathode.
1) Quelle réaction spontanée se déroule lors de l’introduction du cuivre impur dans le bain électrolytique.
2) Écrire la (les) réaction(s) observée(s) à l’anode pendant l’électrolyse. Même question à la cathode.
3) Expliquer l’intérêt de cette méthode quant à la purification du cuivre. Sous quelle forme est récupéré
l’argent ?
Merci d'avance!
-----