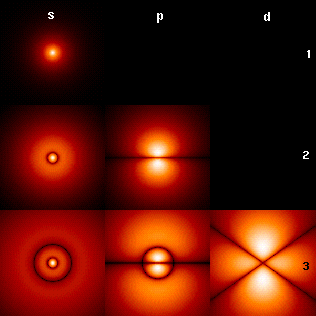
on ne peut pas sonder les échelles auxquelles les atomes nous révèleraient leur vide avec nos sens. La lumière visible a une longueur d'onde bien trop grande pour interagir sélectivement sur les noyaux et les électrons : soit elle est absorbée par l'atome comme un ensemble, soit elle passe au travers (une onde qui a une longueur d'onde plus grande que les obstacles qu'elle rencontre n'est pas perturbée). Nos doigts composés eux-même d'atomes ne peuvent pas non plus percevoir cela. La répulsion entre les nuages électroniques fait que la distance entre deux noyaux n'ait jamais inférieure à une certaine distance et que, par conséquent les atomes se comportent comme des sphères vis-à-vis les uns des autres.Sinon, j'ai lu que l'atome est composé de 99% de vide, donc pourquoi les objets composés d'atomes nous paraissent "plein" ?
Les solides étant un empilement compact d'atomes ou de molécules, ils ne peuvent pas s’interpénétrer et nous apparaissent donc "plein".
m@ch3
-----