Lors d'un laboratoire, nous avons dû synthétiser de l'aspirine (acide acétylsalicylique) à partir d'acide salicylique et d'acétate d'anhydride. A un moment, nous devons filtré pour ne garder que de l'aspirine et pas le polymère qui peut aussi se former. En effet, il y a une estérification mais aussi une polymérisation possible à cause du fait que l'acide salicylique a 2 fonctions (OH et COOH). Pour filtrer, on utilise le fait que le polymère ne réagissent pas avec le NaHCO3 et donc reste insoluble alors que l'aspirine oui, ce qui forme un sel soluble.
Mais je ne comprends pas pourquoi le polymère ne réagit pas avec le NaHCO3 car pour moi, c'est comme une grande molécule sur lequel le Na+ pourrait aller sur le COOH du polymère (en bout de chaîne).
J'espère ne pas m'être trompé dans les réactions mais dans la première pièce jointe j'ai mis la réaction du NaHCO3 avec l'aspirine et dans la 2eme j'ai mis le polymère (c'est surtout pour lui que j'ai peur de m’être trompé).
Je m'étais dit que cela serait dû au fait qu'un polymère est beaucoup plus difficile à faire réagir car beaucoup plus stable, mais je pense que c'est foireux comme explication car on a beaucoup moins de polymère formé que d'aspirine (et comme c'est ce qui est le + formé qui doit etre logiquement le plus stable, c'est contradictoire).
Si quelqu'un pourrait m'éclairer. Merci d'avance.
PS: Je préfère le dire tout de suite, ceci est une de mes questions pour le rapport du labo (la forme du polymère possible aussi). Vous pouvez vous dire que je demande cela juste pour que vous répondez à mon labo à ma place, etc. Mais je demande cela franchement. Ca m'intrigue de ne pas comprendre pourquoi ce polymère ne pourrait pas réagir. J'ai déjà vraiment cherché longtemps là dessus mais sans rien trouvé (même à propos du polymère formé). C'est vraiment parce que je bloque que je viens demander de l'aide.
-----



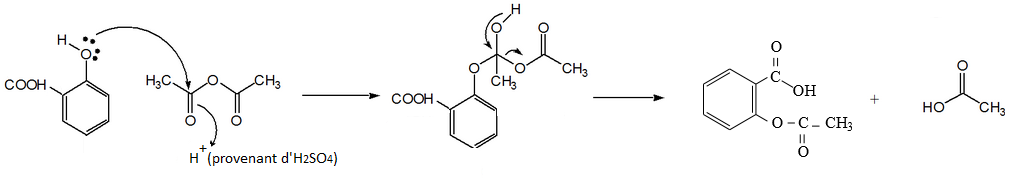
 C'est ce que j'appelle une réponse nette et précise. C'est vrai que je me suis tout de suite dit que le polymère n'allait pas réagir avec le Na alors qu'il le peut. J'ai pas cherché asse loin. Encore merci en tout cas
C'est ce que j'appelle une réponse nette et précise. C'est vrai que je me suis tout de suite dit que le polymère n'allait pas réagir avec le Na alors qu'il le peut. J'ai pas cherché asse loin. Encore merci en tout cas 