Bonjour à tous,
J'ai une petite question que je me pose depuis un moment concernant la précipitation du calcaire en fonction du pH de l'eau. Désolé si je ne suis pas très clair, je ne suis pas expert en chimie
J'ai trouvé les données suivantes :
"A une minéralisation donnée (TH et TAC définis), Tillmans a montré qu’il existe un pH dit pH de saturation (pHs) ou pH d’équilibre au-delà duquel il va être observé une précipitation des ions calcium et bicarbonate sous forme de carbonate de calcium."
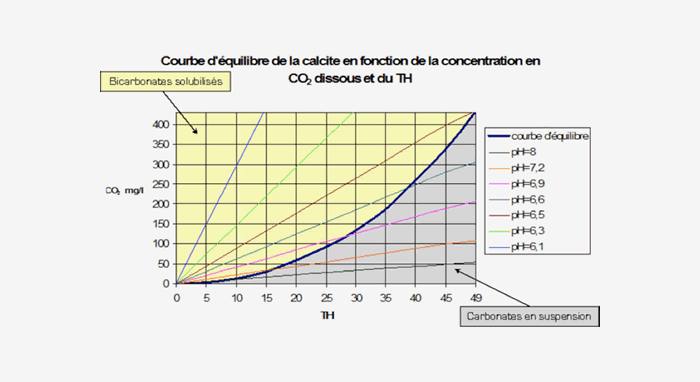
J'ai également trouvé la courbe "simplifiée" suivante :
Ma question est la suivante : est-ce qu'il est nécessaire d'atteindre absolument le pH d'équilibre pour précipiter le calcaire ? Ou est-ce que même si le pH est en dessous du pH d'équilibre une partie sera précipitée mais pas la totalité ?
Par exemple avec la courbe ci-dessus, si j'ai un TH de 40 et un pH de 6,9 est-ce qu'une partie du calcaire est précipitée ou est-ce qu'il est nécessaire d'atteindre absolument un pH > à 6,6 ?
Merci d'avance pour votre aide et vos réponses.
Cordialement,
Loïc
-----