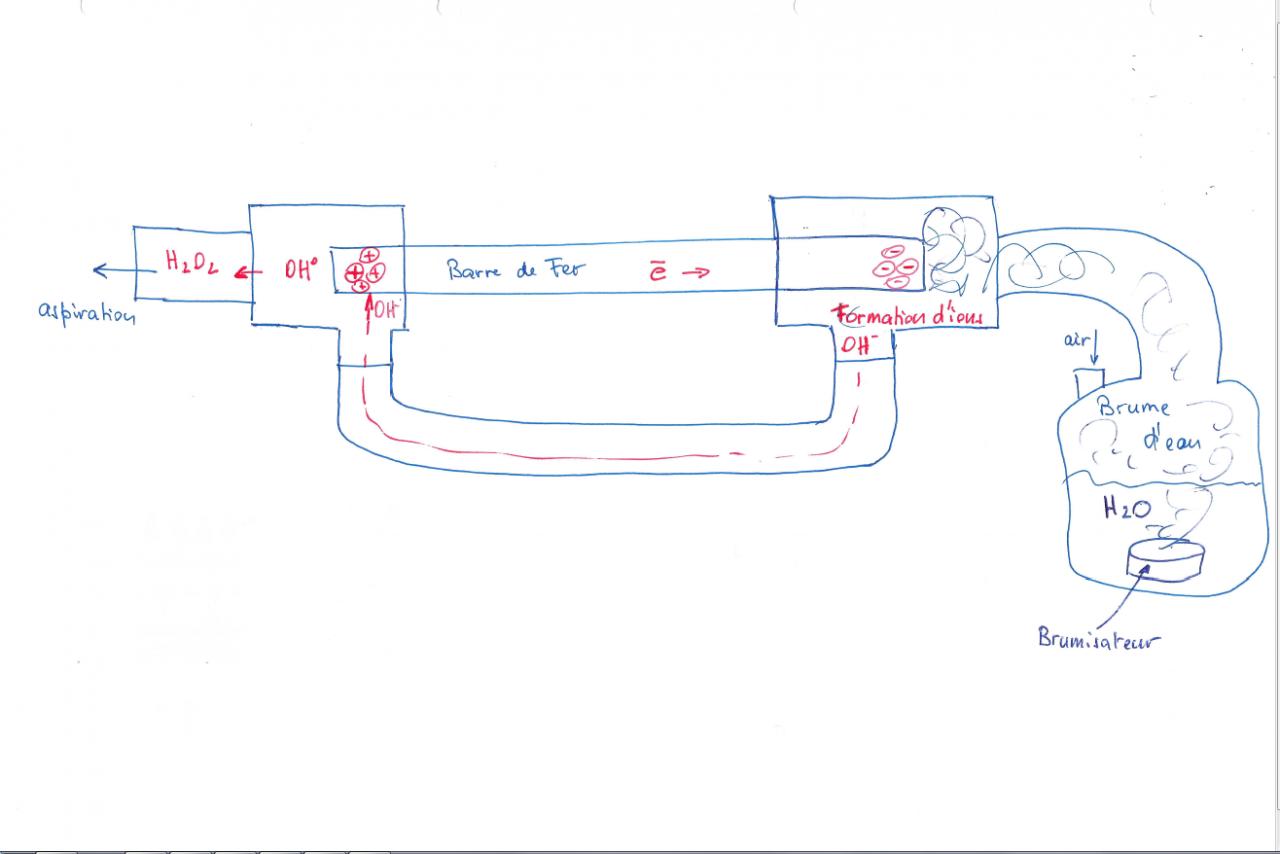
Salut,
Un pont salin permet le transport des charges d'une demi-pile à l'autre, grâce à la migration des ions. Ainsi, les cations du pont salin (souvent K+) migrent-ils vers la cathode et les anions (souvent NO3-) vers l'anode pour compenser les déficits de charge dus à l'arrivée d'électrons à la cathode et à leur départ de l'anode.
Ma question est: Est-ce qu'un champ électrique à l'intérieur d'une pile permet se déplacement? Si oui, ce champ provient-il de la separation de charge à la surface des electrodes?
-----