Bonjour, alors voilà dans mon cours j'ai affaire à ces deux équations (et sûrement plus tard à d'autres similaires), sauf que je ne parviens pas à trouver comment on passe des réactifs aux produits ... Il y a une méthode pour savoir quels atomes/ions doivent être associés entre eux?
Si vous pouviez me montrer en détaillé comment faire sur au moins une des deux ce serait vraiment gentil, je bloque là dessus :s
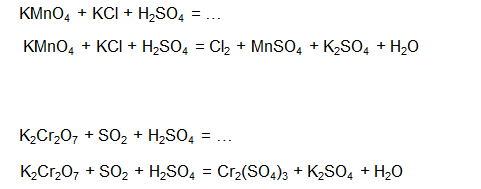
-----


