Bonjour
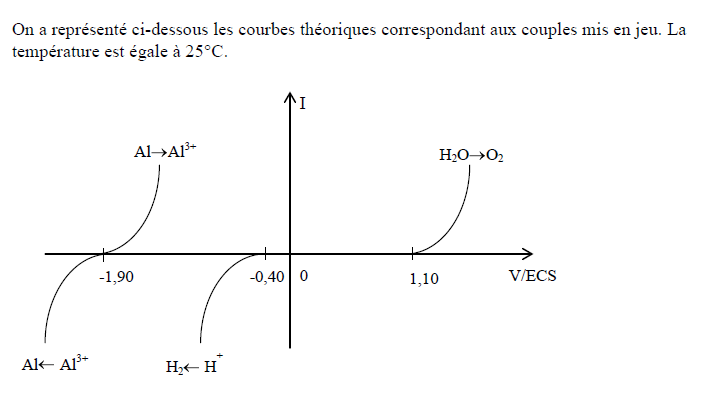
J'ai une question sur l'électrolyse d'une solution aluminium. A partir des courbes théoriques (voir image jointe), je dois prévoir s’il est possible de déposer de l’aluminium métallique sur l’électrode d’aluminium ou de dissoudre l’électrode d’aluminium.
Je n'ai jamais aimé les courbes intensité potentiel et là je bloque complètement !
Merci pour votre aide.
-----



