Bonjour,
je n'arrive pas bien à comprendre les diagramme moléculaire pour les molécules de type AH.
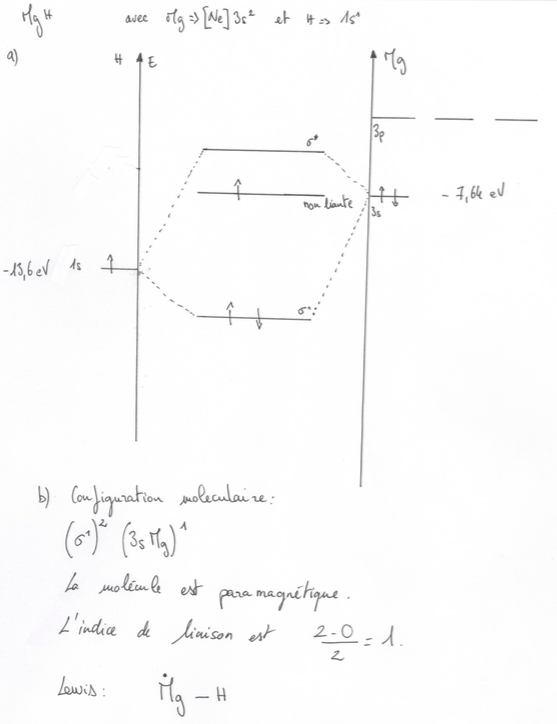
Voici ce que j'ai fait pour MgH.
Je pense que l'ordre de liaison est faux mais n'en suis pas certain.
Merci.
-----


Bonjour,
je n'arrive pas bien à comprendre les diagramme moléculaire pour les molécules de type AH.
Voici ce que j'ai fait pour MgH.
Je pense que l'ordre de liaison est faux mais n'en suis pas certain.
Merci.


Pourquoi étudier une molécule qui n'existe pas ? A quoi bon ?


Peut-être pour dire pourquoi elle n'existe pas ?
Je ne sais pas. C'est un exercice en atomistique.
Je crois avoir lu que Mg et H sont plus de la forme MGH2, mais c'est bien MgH qui est dans mon exercice. Et j'ai du mal à définir comment cela se passe !


Personne pour la molécule inconnue MgH ?
En théorie, elle pourrait exister, puisqu'elle a un ordre de liaison >0..?
Sur le diagramme, je me demande si je dois construire l'orbitale pz... Ou si vu qu'il n'y a pas d'électron dessus, on ne s'en préoccupe pas...?

Bonjour,
Il doit toujours y avoir autant d'orbitales hybridées que d'orbitales initiales. Et ces hybridations se font indépendamment du remplissage, qui se fera en un deuxième temps
En toute rigueur il faudrait mélanger les trois orbitales susceptibles d'interagir (1s de H, 3s de Mg, 3pz de Mg) pour donner 3 orbitales hybridées de type sigma,
Mais le 3pz étant encore plus haut que le 3s*, on doit pouvoir sans trop de scrupules le considérer comme non liant et se contenter d'hybrider 1s de H et 3s de Mg
Ces deux niveaux vont faire une sigma et une sigma* (NB :deux orbitales seulement et pas de non liante en plus: votre diagramme est faux)
Et cela donne un indice de liaison de 0,5
Cette molécule existe en effet, mais il faut des conditions assez particulières
https://en.wikipedia.org/wiki/Magnesium_monohydride
* Le niveau 3p de Mg est à 2,7 eV au dessus du 3s
Dernière modification par Resartus ; 20/02/2017 à 10h21.
Why, sometimes I've believed as many as six impossible things before breakfast


Merci resartus.
Ça m'éclaire énormément. Finalement, c'est passionnant MgH !
Mais ma curiosité m'amène à d'autres questions.
Que fait la chaleur dans les niveaux d'énergie pour que la molécule puisse exister uniquement à certains températures ?
Par ailleurs, avec naiveté, je me dis que si on ajoute un H, le niveau anticipant devient "égal" au liant. Et donc la molécule ne peut exister. Les molécules du type AH2 ne sont pas à mon programme, mais si l'explication est simple, ça m'intéresse de l'avoir.
Je mets en PJ le diagramme et indice de liaison corrigé. Est-ce cela ?
Bonne journée à tous.
*le - de 13,6eV est coupé par la copie d'écran.

Bonjour,
Au vu de vos difficultés, je comprends que vous n'avez encore jamais vu d'hybridations mélangeant plus de 2 orbitales
Votre diagramme est faux, car il ne respecte pas la règle que le nombre d'orbitales doit rester le même.
Les orbitales 3px et 3py ne peuvent pas s'hybrider, et on les recopie telles quelles au milieu à -5,93 eV
Si on suppose, comme je le proposais, un modèle simplifié où le niveau 3pz de Mg est également inchangé, on recopie ce niveau tel quel au milieu avec une énergie de -5,93. Votre partie haute est donc fausse (On remarque que dans ce cas, on pouvait oublier complétement l'influence des niveaux 3p et donc les omettre dans les diagrammes).
L'hybridation se fait seulement entre le 1s de H et le 3s de Mg. C'est le cas classique d'hybridation entre deux niveaux et votre dessin de la partie basse est OK.
Si par contre on voulait inclure dans l'hybridation le niveau 3pz, on aurait alors trois niveaux hybridés (et pas quatre) qui seront trois combinaisons avec certains coefficients de la 1s du H, de la 3s du Mg et de la 3pz de Mg :
1 sigma basse liante en dessous du 1H (environ à -14),qui contient surtout du H et un peu de 3S, une sigma haute antiliante un peu au dessus mais proche du 3p qui ne contient pratiquement que du 3p avec très peu de 1H, et une sigma intermédiaire située entre -5,93 et -7,64 qui va contenir beaucoup de 3S, un peu de 1H et un peu de 3p
Mais si ce n'est pas dans vos cours, il vaut mieux ne pas toucher à ce genre de subtilités.
Why, sometimes I've believed as many as six impossible things before breakfast


Merci encore pour ce temps pris à m'expliquer.
On a un court paragraphe sur les molécules de type AH, mais les cas décrits dans le cours semblent plus simples.
Je n'ai pas compris pourquoi des électrons présents sur des orbitales S iraient s'hybrider en p.
Je comprends que la pz est sur le même axe que les S, mais si celle-ci est vide, comment joue-t-elle un rôle ?
Je cherche des lectures pour mieux comprendre. Mais internet est assez rapide sur le sujet.
Je suis en L1 Biologie donc effectivement, on est un peu en bordure de programme. Je ne pense pas qu'on nous demandera cela à l'examen.
Merci encore.
*je vais tenter de faire le diagramme comme indiqué.
Pour le "simplifié", j'ai enlevé la partie haute comme ci-dessous.
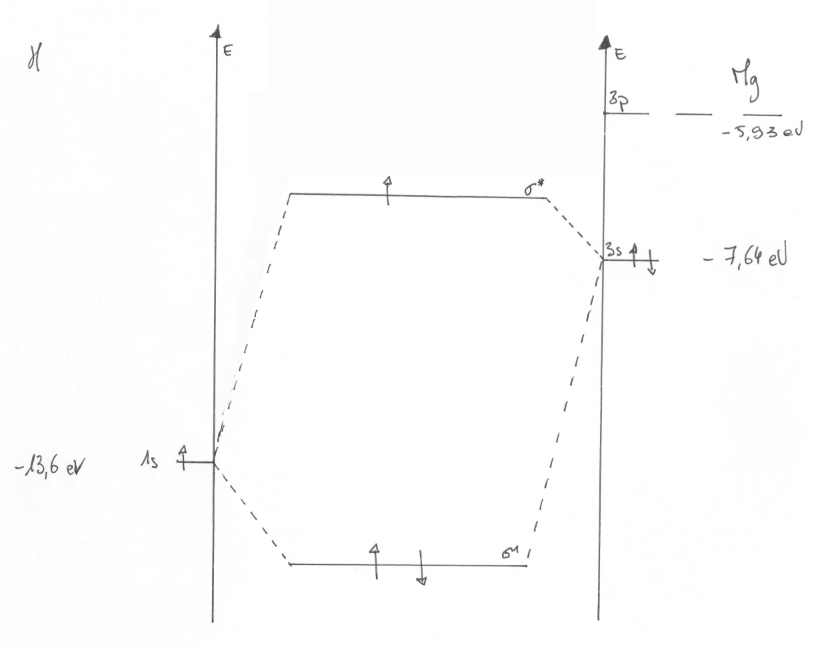


Je suis en train d'essayer le diagramme plus complexe. Et je me demande : le second électron de Mg, va-t-til sur la sigma intermédiaire ou sur la sigma haute antiliante ?
S'il va sur l'intermédiaire, l'ordre de liaison change ?
Merci.


Voici ce que j'ai fait pour la forme prenant en compte le niveau 3pz.
Mais je ne sais pas où placer l'électron afin que l'ordre de liaison reste le même...
Car le niveau intermédiaire n'est pas antiliant ?
Merci de votre aide. C'est ma dernière tentative après j'arrête de vous embêter, promis.

Bonjour
C'est bien cela (sauf que le niveau du bas n'est pas *). Et le remplissage se fait toujours en partant du bas vers les énergies croissantes. L'électron oublié est à mettre sur ce niveau intermédiaire.
Comme ce niveau "intermédiaire" est plus haut que sa composante principale qui est le 3s de Mg, il est bien antiliant, mais
la présence de l'orbitale 3p au dessus a quand même eu pour effet de descendre un peu ce niveau par rapport au modèle à 2 orbitales.
C'est le même phénomène (mais à l'envers) que vous avez dû voir sur les molécules de type C2,N2,O2 : la présence des orbitales 1s assez proches faisait remonter le niveau de l'hybridation liante sigma2s, qui, pour les molécules jusqu'à N2, finit par se retrouver au dessus des deux sigma2p...
On peut faire des calculs matriciels pour montrer cela, et trouver les valeurs des coefficients et des énergies dans ce modèle dit de combinaisons linéaires d'orbitales atomiques, mais AMHA, cela n'a que peu d'intérêt, sachant que de toutes façons ce modèle n'est qu'une approximation qui néglige en particulier l'effet de la répulsion électronique (et les interactions spin/orbite : si vous avez lu la description Wikipedia de MgH, vous avez vu que les niveaux d'énergie sont autrement plus complexes)
Autant rester dans du qualitatif avec des petits dessins de lobes qui se recouvrent plus ou moins....Ce qu'on pourrait appeler de la meca Q pour chimistes (ou pour biologistes, quoique je ne sais pas trop dans quelle mesure vous aurez ultérieurement besoin de ce genre de choses)
Dernière modification par Resartus ; 21/02/2017 à 14h10.
Why, sometimes I've believed as many as six impossible things before breakfast

Et il manque aussi une liaison en pointillés entre le niveau 3pz et le sigma du bas
Why, sometimes I've believed as many as six impossible things before breakfast


Super. Merci pour toutes ces informations. Auriez-vous un livre ou des lectures à me recommander pour comprendre un peu mieux ces phénomènes ? Je suis toujours un peu frustré par les explications hâtives dans les livres que j'ai (type le Mini-Manuel ou un autre chez Edisciences en Chimie Orga). Ça m'évitera peut-être de vous faire perdre votre temps
Je comprends mieux pour le niveau intermédiaire. Et du coup, on a deux niveaux anti-liants.
Bonne après-midi.

