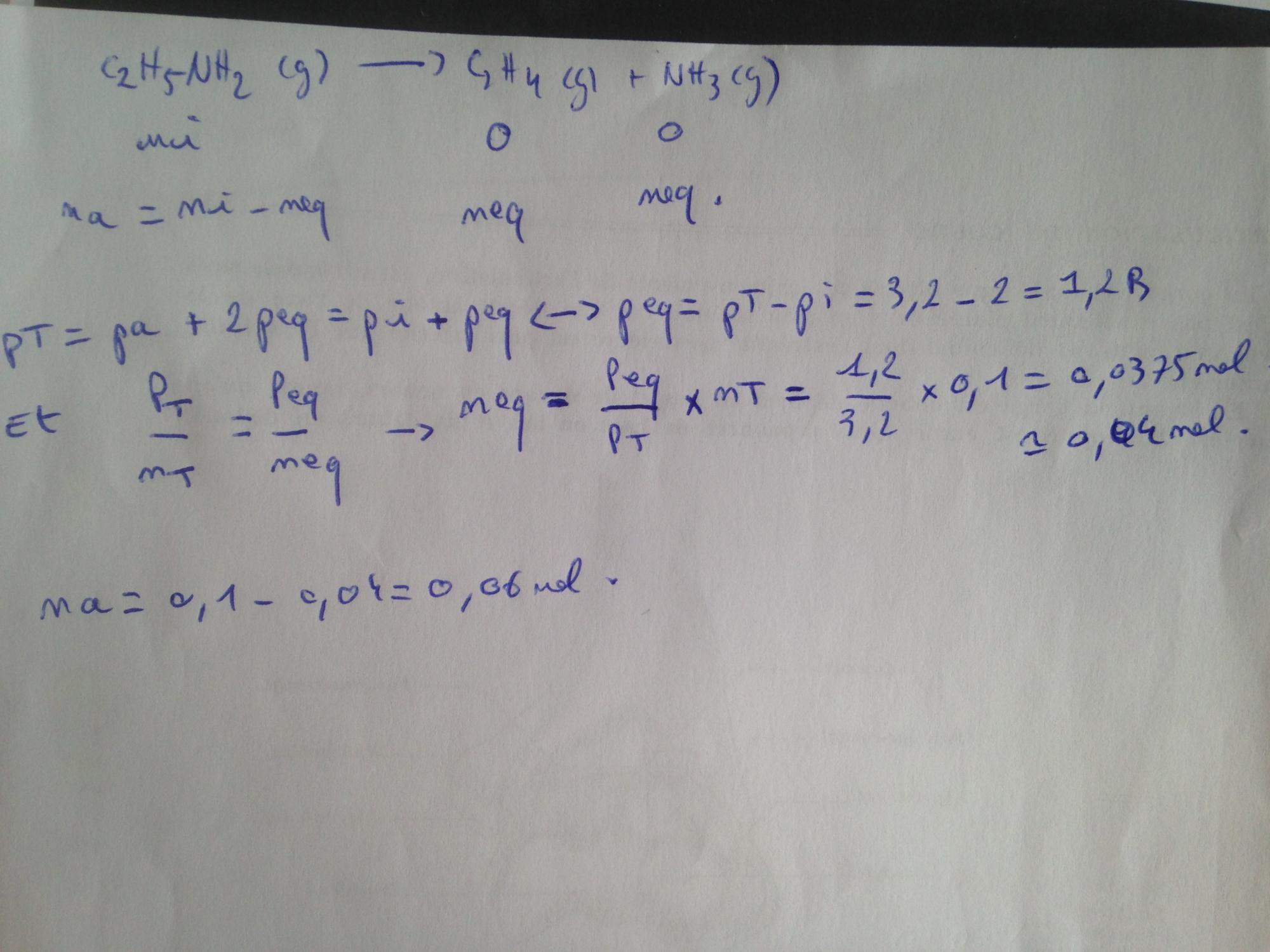Bonjour à tous :
Dans un récipient à volume constant préalablement vidé d'air, on introduit 0,1 mole de C2H5NH2 à température 500K.
Soit la réaction :
C2H5NH2(g) qui donne lentement : C2H4(g) + NH3 (g)
La pression initial de C2H5NH2(g) est de 2 Bar.
Et lorsque l'équilibre est établi, la pression d'équilibre dans le récipient est de 3,2 Bar.
Quelles sont les quantités de matière à l'équilibre ?
Je trouve n(C2H5NH2)= 0,06 mole et n(Nh3)=n(C2h4)= 0,04mole .
Mais la correction me met l'inverse.
Merci pour vos future réponses.
-----