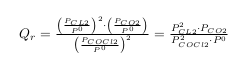Bonjour/Bonsoir,
2COCl2 (g) -----> C (graphite) + CO2 (g) + 2Cl2 (g)
<-----
réaction de décomposition thermique de COCl2 (g) à 400 degrés sous une pression d' 1 bar.
Pour moi le sens endothermique est le sens de la 2 ème flèche non ?
En faite ma question se porte plutôt sur le calcul de la constante d'équilibre. Elle prend en compte, la concentration du carbone graphite, le dioxyde de carbone, le dichlore et le phosgène ? Donc au final des réactifs et des produits ? où je me trompe ?
Donc du coup l'expression de la constante d'équilibre est : K = x(2x)^2 / (1-2x)^2 ( avec x = pression partielle de CO2 dans le mélange)
Merci pour vos futures réponses.
-----