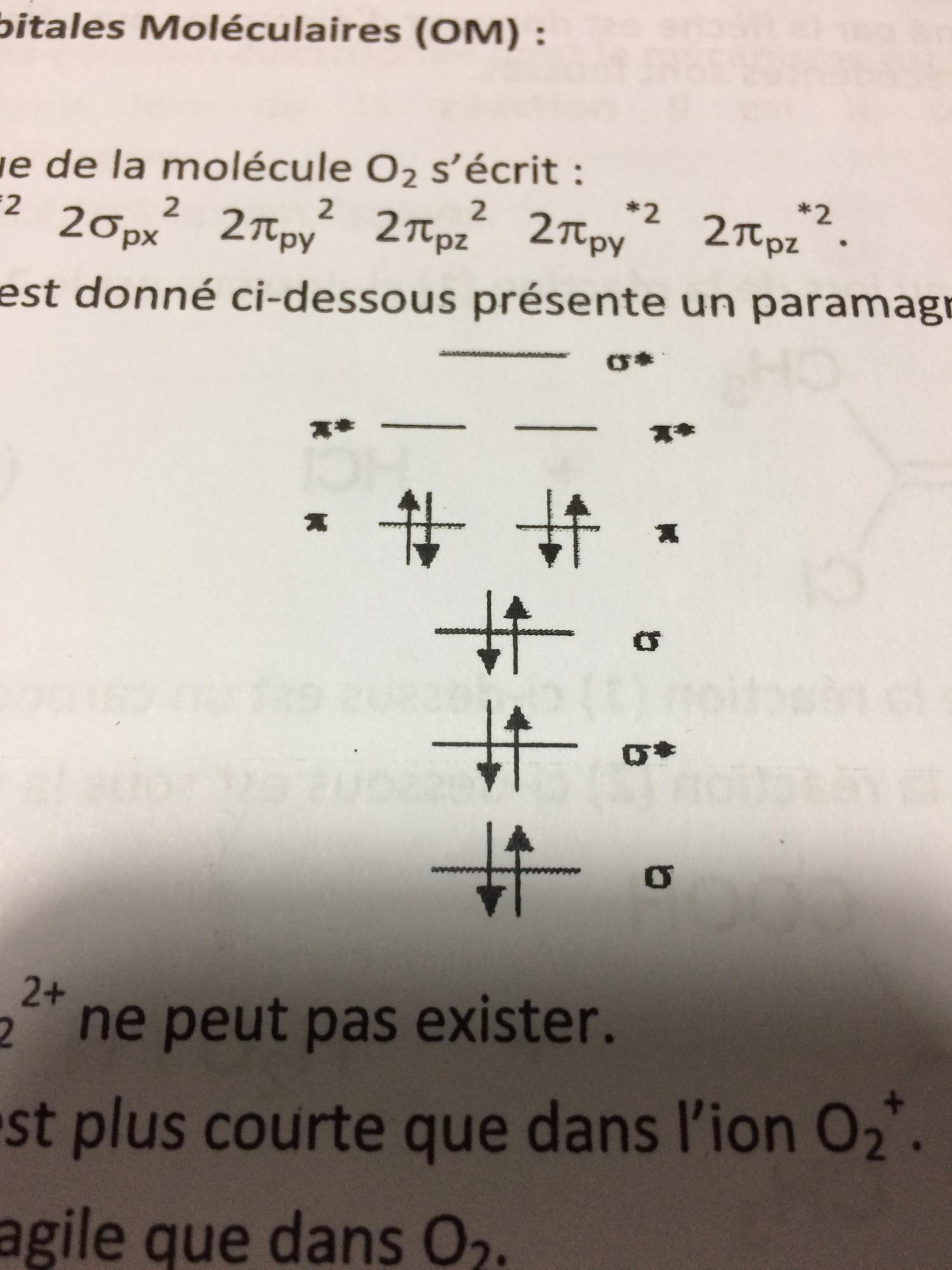Bonjour,
J'ai une petite question sur une phrase que je ne parviens pas à comprendre...
"L'ion O2+ présente un paramagnétisme plus faible que O2"
D'après ce que j'ai compris, plus il y a d'électrons libre plus le paramagnétisme est élevé... Or O2 possède 2 électrons célibataires et l'ion O2+ possèdent pas d'électrons célibataire...
Merci d'avance pour votre aide ^^
-----