Bonjour tout le monde !
Je me trouve bloquée devant cet exercice (QCM)je n'ai pas pu le résoudre je serais très reconnaissante si vous m'aidiez !
______________________________ __________
Une solution qui contient:
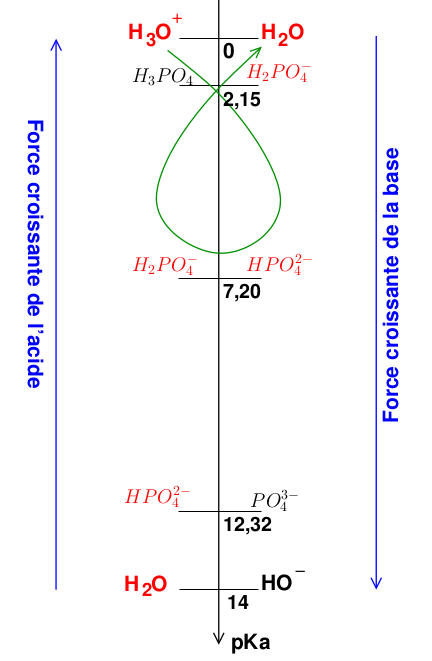
[H2PO4(-)]=0.25mmol/L
[HPO4(-2)]=1mmol/L
-Quelle concentration de H3O(+) (en mmol/L) faut-il il ajouter à cette solution pour diminuer son ph d'une unité ?
-On nous donnent les choix suivant :
{ 0.52 / 0.56 / 0.60 / 0.64 / 0.70}
______________________________ ___________
En plus je voudrais savoir qu'est ce qu'on veut dire par unité ? Unité=1 ?
______________________________ ___________
Merci de me répondre. Bonne journée à vous !
-----