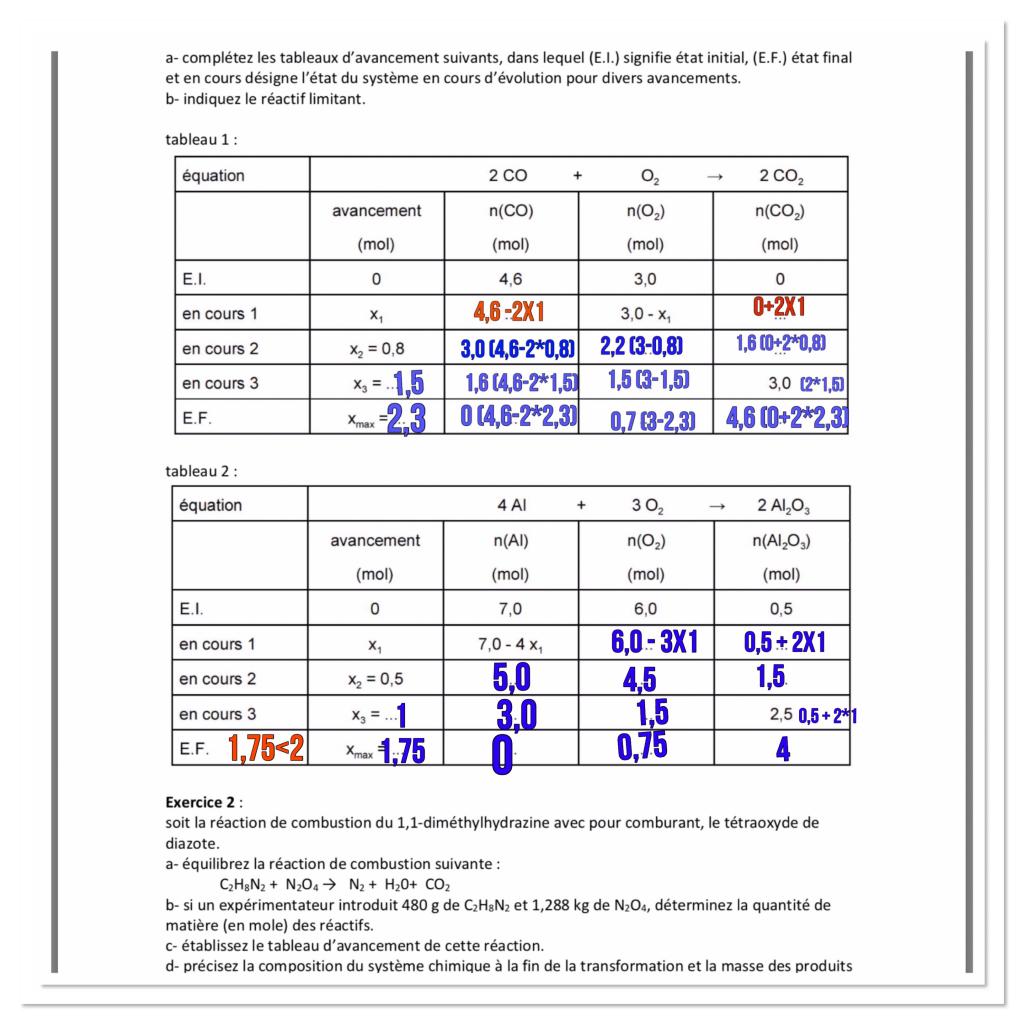
Bonjour, c’est encore moi pour ceux qui m’ont aidée au topic précédent.
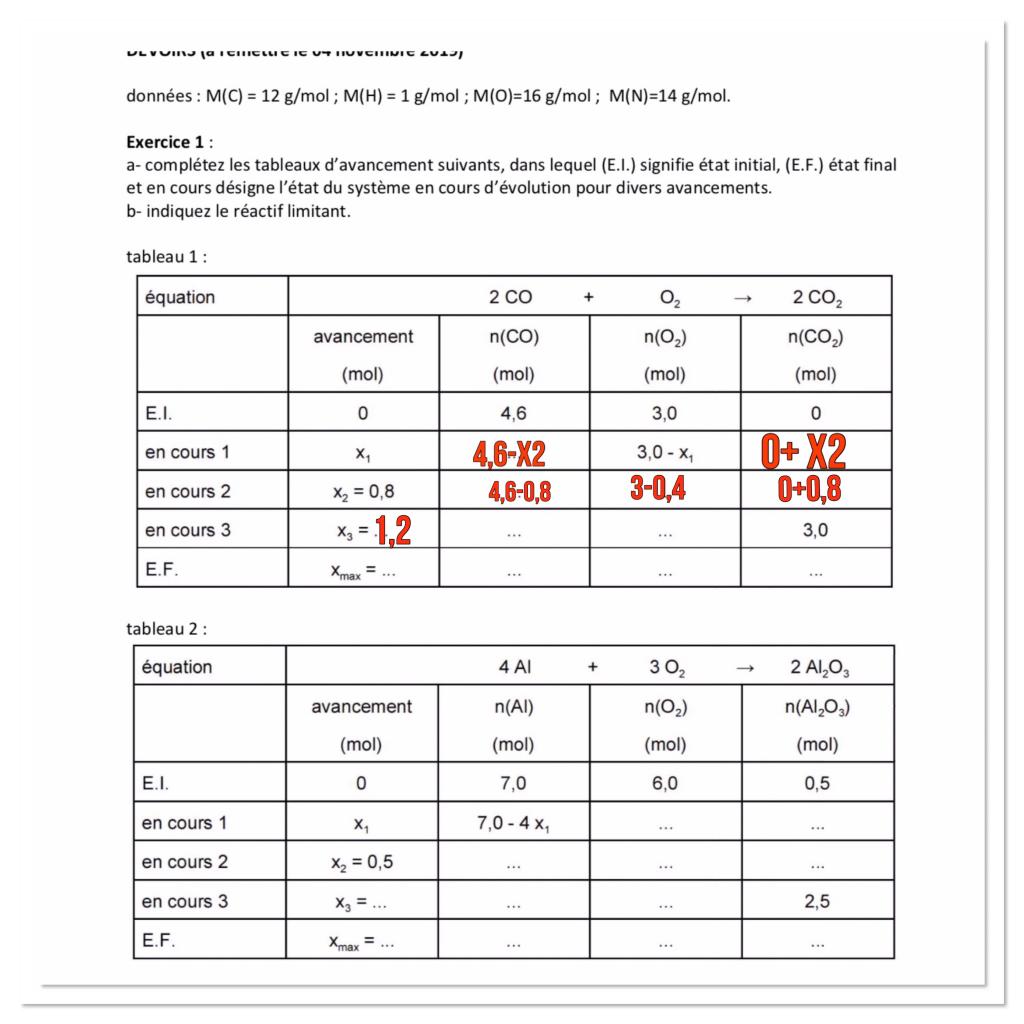
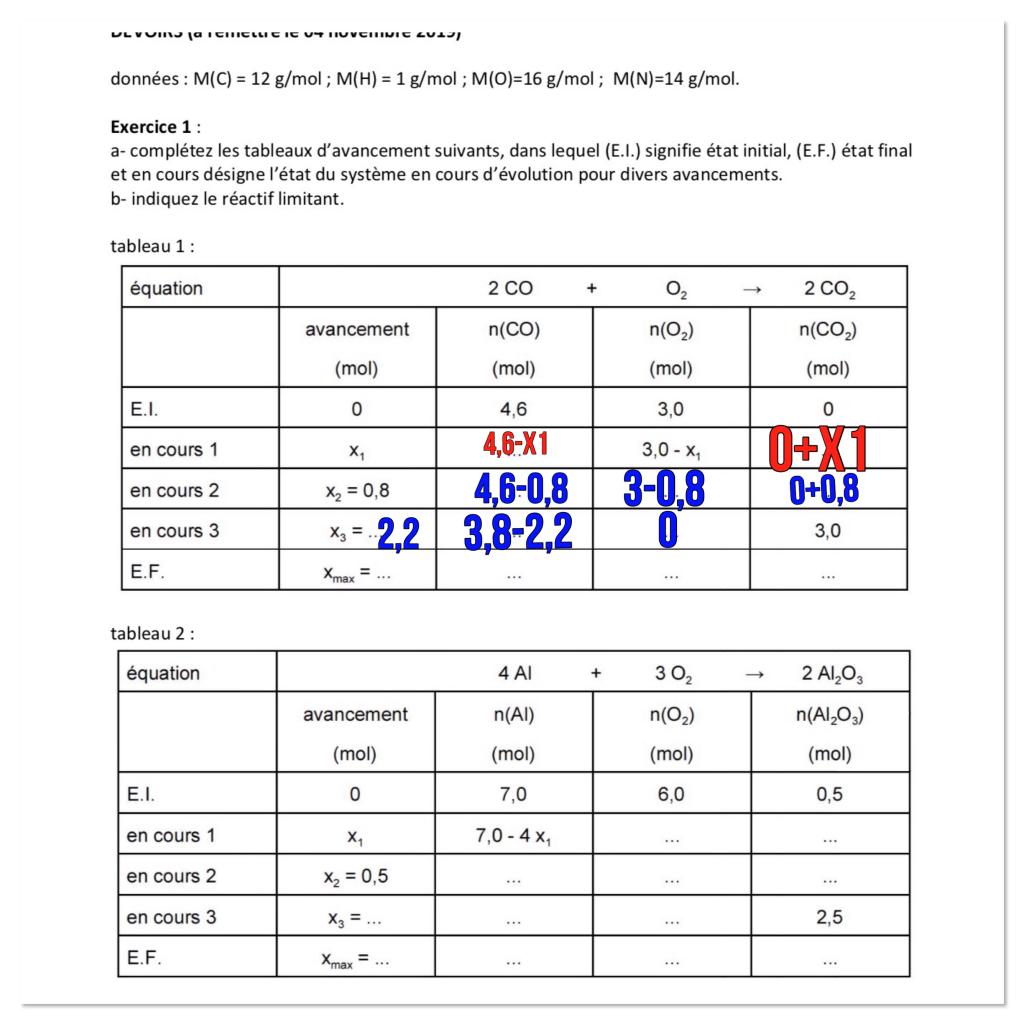
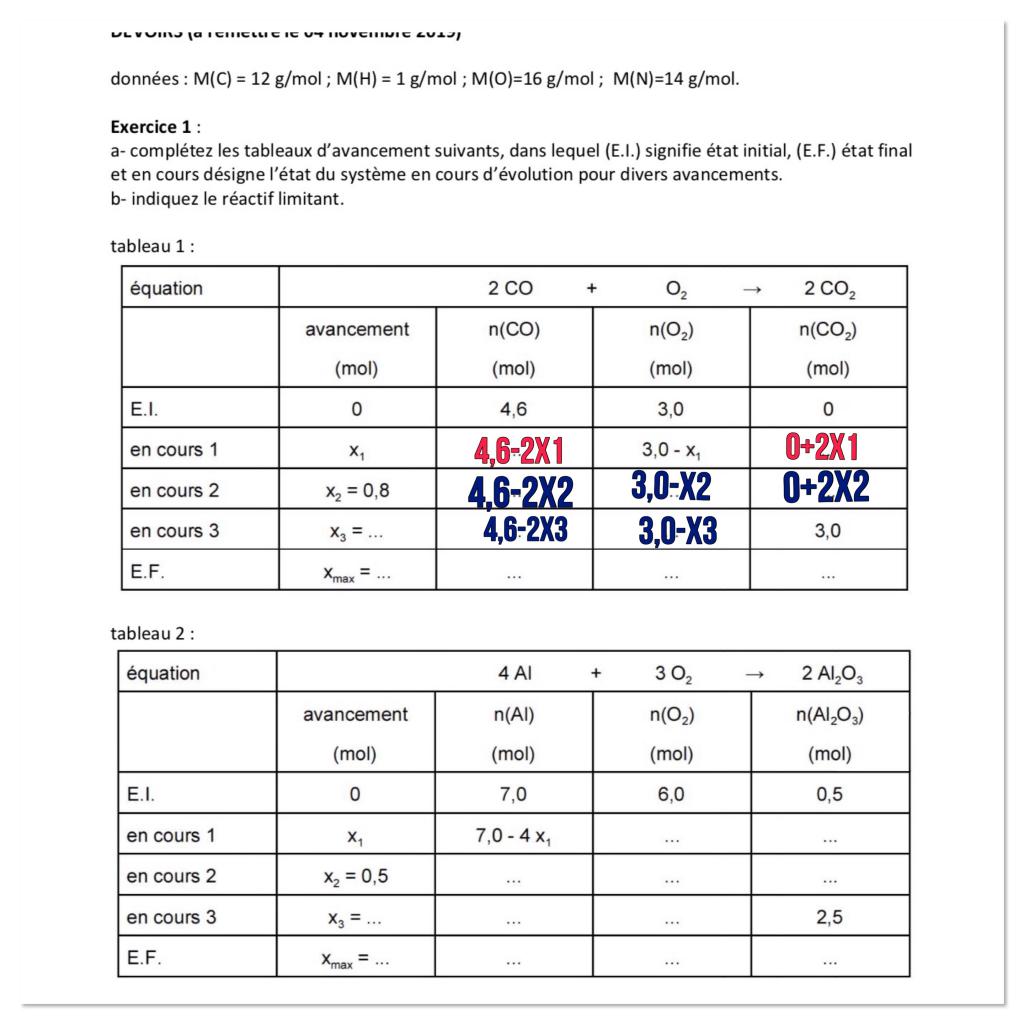
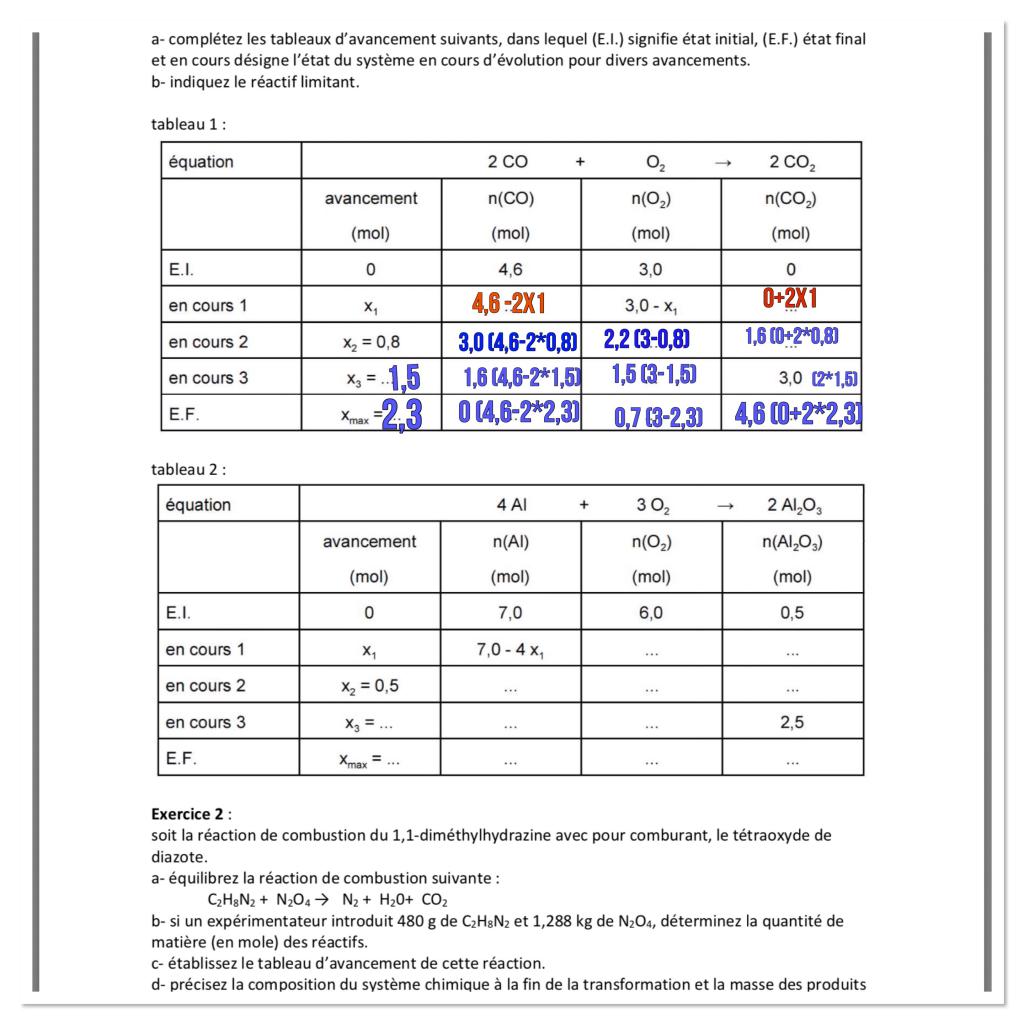
Je souhaite vous demander de l’aide pour un exercice sur les tableaux d’avancement (L’énoncé est ci-dessous) . J’ai essayé de remplir le 1er tableau, cependant j’ai réussi qu’à remplir la ligne du tableau «*en cours 1*». Si quelqu’un peut m’expliquer très clairement et le plus facilement possible ce qu’il se passe pendant une réaction chimique ceci sera très généreux de sa part. Merci d’avance !
Énoncé
FDF1FC56-7EFA-4CB9-A18B-674B335E9E81.jpg
Mes 2 pauvres réponses :
53A7B995-D639-46A8-A417-8535E278E045.jpg
-----