Bonjour,
Je souhaite déterminer la constante d'équilibre de la réaction suivante:
Capture 2.PNG
Je pense avoir une piste mais je voudrais confirmer ma démarche.
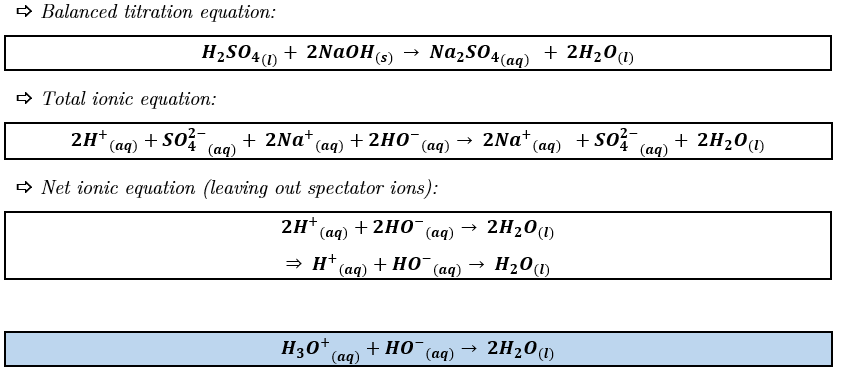
En simplifiant l'équation, je tombe sur l'équation de l'autoprotolyse de l'eau.
Je pensais donc écrire:
Capture 3.PNG
Mais puisque l'eau est le solvant, son activité est égale à 1 donc sa concentration n'est pas prise en compte dans le calcul de la constante, ce qui nous donne:
K = 1/Ke = 10^14
Pourriez-vous, s'il vous plaît, m'indiquer si ma démarche est correcte?
Merci d'avance à tous ceux qui prendront le temps d'examiner ma demande.
-----